Kovy alkalických zemín
Týmto názvom označujeme niektoré prvky II.A skupiny, ale nie všetkých šesť prvkov z II.A skupiny sa radí medzi kovy alkalických zemín. Patria sem len štyri prvky s podobnými vlastnosťami: vápnik, stroncium, bárium a rádium.
Berýlium a horčík sa od nich svojimi vlastnosťami líšia. V rámci periodickej tabuľky sú v rovnakej skupine, ale neradíme ich medzi kovy alkalických zemín.
Všetky prvky II. skupiny majú na valenčnej vrstve dva elektróny – v zlúčeninách majú vždy oxidačné číslo II.
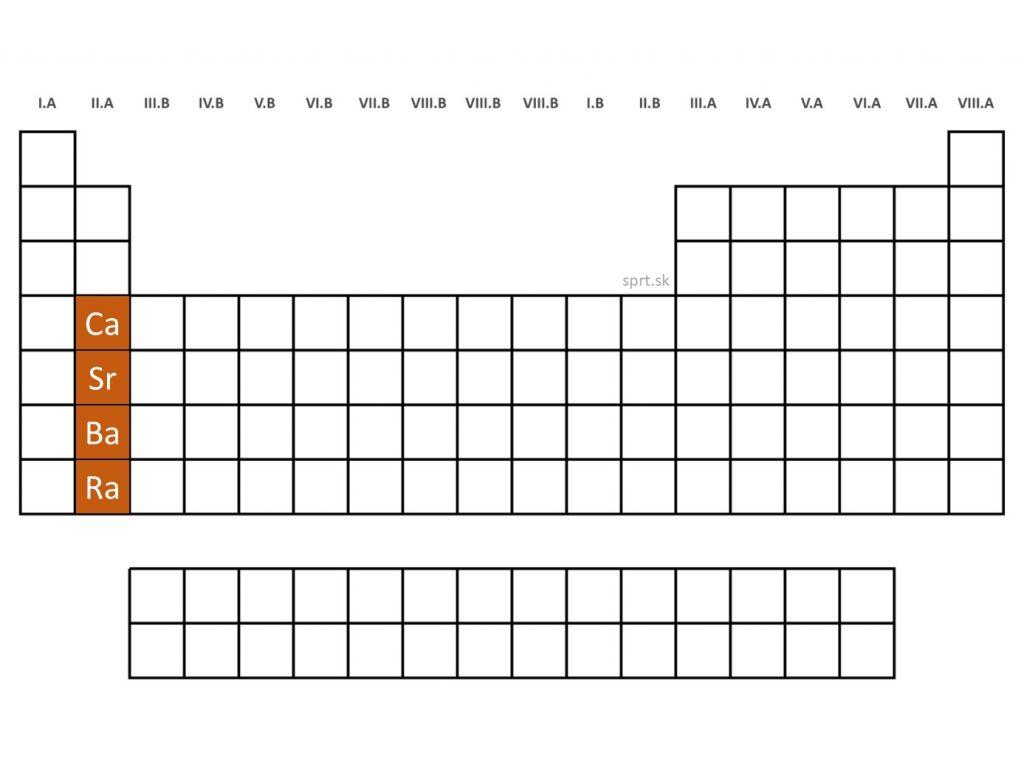
Sú to striebrolesklé neušľachtilé kovy, tvrdšie a menej reaktívne ako alkalické kovy, taktiež majú oproti nim vyššiu hustotu. Rovnako však reagujú s vodou, len o niečo pomalšie. Väčšinou tvoria iónové väzby. Vyskytujú sa iba v zlúčeninách.
Rozpustené soli stroncia a bária sú jedovaté.
Najčastejšie sa vyrábajú elektrolýzou tavenín chloridov, alebo redukciou príslušných halogenidov sodíkom.
Reagujú s kyselinami za vzniku vodíku.
Hydroxidy týchto kovov sú silné zásady, vznikajú reakciou s vodou.
Chloridy jednotlivých prvkov farbia plameň – vápnik na červeno, stroncium na karmínovo a bárium na žlto-zeleno.
Zásaditosť, reaktivita a rozpustnosť sa v stĺpci zväčšujú zhora nadol. So zväčšujúcim sa atómovým číslom naopak klesá elektronegativita.
Popis prvkov
Vápnik - Ca (Calcium)
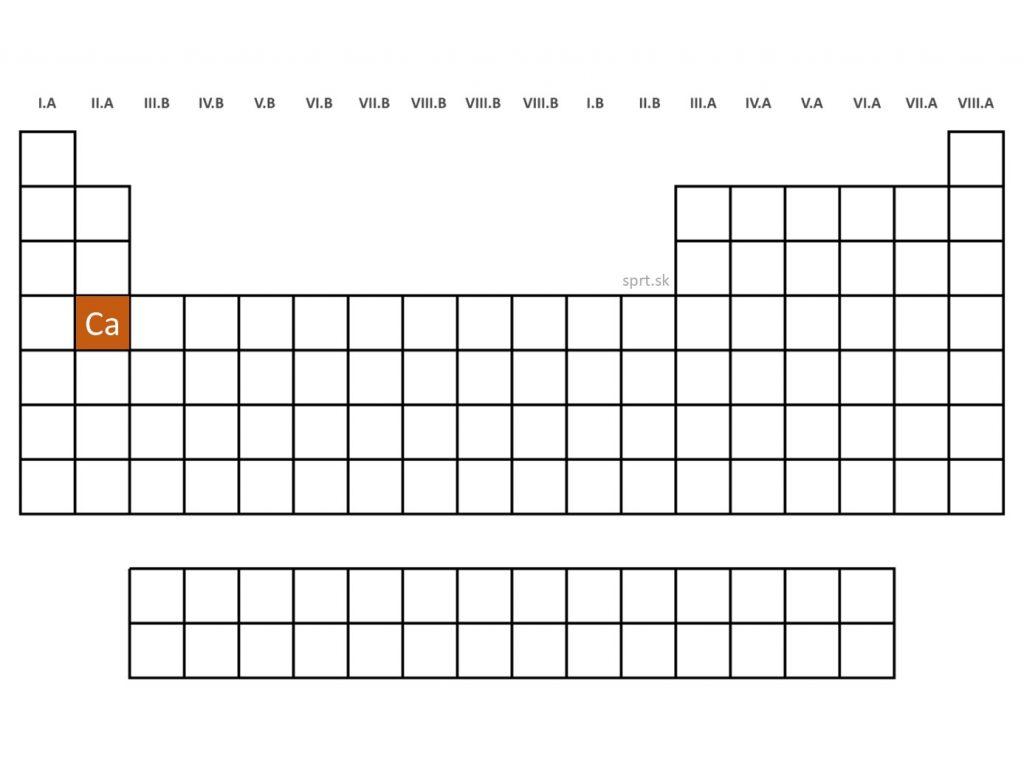
Vápnik je mäkký, kujný a veľmi reaktívny kov, ktorý sa používa ako redukčné činidlo v metalurgii (odstraňovanie síry a kyslíka z ocele) a taktiež sa pridáva do špeciálnych zliatin. Okrem toho má uplatnenie aj pri výrobe vápenatých skiel a v stavebníctve vo forme páleného/haseného vápna, ktorého kombináciou so sadrou vzniká cement. Vyskytuje sa napríklad vo vápenci, sádrovci, alebo apatite. Radí sa medzi biogénne prvky.
Stroncium - Sr (Strontium)
Stroncium je celkom vzácny prvok, 15. najrozšírenejší v zemskej kôre. Vyskytuje sa napríklad v strontianite, alebo celestine. On aj jeho zlúčeniny majú podobné vlastnosti ako vápnik.
Používa sa ako žlté farbivo v pyrotechnike a pri katódových trubiciach.
Bárium - Ba (Barium)
Bárium je taktiež veľmi mäkký kujný a reaktívny kov. V zemskej kôre je 14-tym najrozšírenejším prvkom. Tvorí iónové zlúčeniny, ako aj ostatné kovy alkalických zemín.
Vyskytuje sa najčastejšie vo forme minerálu baryt. Je podobný alkalickým kovom, odlišuje sa od nich však malou rozpustnosťou.
Najväčšie využitie má v pyrotechnike (farbenie na zeleno), pri ťažbe ropy, v gumárenskom priemysle, medicínskom priemysle a ako súčasť batérií do elektromobilov.
Rádium - Ra (Radium)
Rádium má všetky izotopy rádioaktívne. Ich rozpad je veľmi rýchly, preto je rádium vzácnym prvkom.
Využívané bolo na tzv. rádioterapiu, t.j. ožarovanie zhubných nádorov. V súčasnosti sa na túto liečbu už nevyužíva.
Názov kovy alkalických zemín majú tieto prvky preto, lebo sa nachádzajú v zemskej kôre.
Pri laboratórnej teplote (20 – 25°C) oxidujú, takže sú silnými redukovadlami.
Biogénne prvky II.A skupiny
Vápnik - Ca (Calcium), Horčík - Mg (Magnesium)

Vápnik (Ca) a horčík (Mg), ktorý je súčasťou II.A skupiny, no nezaraďujeme ho medzi kovy alkalických zemín, patria do skupiny esenciálnych biogénnych prvkov.
Sú veľmi dôležité!
Vápnik sa podieľa na stavbe kostí, zrážaní krvi, činnosti svalov, aj nervového systému.
Horčík má antistresové, protizápalové a protialergické účinky, taktiež je dôležitý pri zrážaní krvi a pri rastlinách je súčasťou chlorofylu.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
DVOŘÁČKOVÁ. 2013. Chemie pro každého. Olomouc. Rubico