Atóm
Atóm je základnou stavebnou časticou všetkých prvkov, všetkej hmoty.
Tvorí ho jadro a elektrónový obal.
V jadre atómu sa nachádzajú protóny a neutróny, spoločným názvom nukleóny.

Na úvod trochu histórie
1)
Približne 400 rokov pred Kristom skúmal stavbu predmetov antický filozof Leukipos a jeho žiak Demokritos.
Demokritos vyslovil myšlienku, že existuje malá čiastočka, z ktorej sa skladá absolútne všetko. Bol presvedčený, že objavil najmenšiu časticu, aká existuje, ktorá už ďalej nie je deliteľná. Preto ju pomenoval podľa gréckeho slova atomos = nedeliteľný.
2)
Aristoteles, starogrécky filozof, polyhistor, zakladateľ špeciálnych odborov ako je logika, zoológia, meteorológia, či psychológia, ktorý žil v období 384 – 322 r. pred Kristom, definoval 5 základných elementov života – oheň, voda, zem, vzduch a éter.
3)
Moderný koncept atómu prinieslo obdobie 18.-19.-teho storočia. Založený bol vedecky, na chemických vlastnostiach látok.
Moderný koncept atómu a jeho modely
Na začiatku 19. storočia sa začal atómom venovať John Dalton, ktorý v roku 1808 predstavil svoju hypotézu.
Svoje pozorovania a zistenia spísal to troch zákonov:
1) Všetka hmota sa skladá z atómov. Tie sú nedeliteľné a nezničiteľné. Všetky atómy daného prvku majú rovnakú hmotnosť aj vlastnosti.
2) Zlúčeniny sú tvorené dvoma, alebo viacerými rôznymi druhmi atómov.
3) Počas chemickej reakcie sa atómy nanovo usporiadajú.
Vo svojich teóriách sa však nijako nevenoval zloženiu (modelu) atómu.
Thomsonov (pudingový) model atómu
Objav elektrónu sa pripisuje J. J. Thomsonovi, ktorý tým začiatkom 20. storočia vyvrátil teóriu o nedeliteľnosti atómu.
V roku 1904 vytvoril model atómu, nazývaný Thomsonov model, alebo tiež pudingový model.
V čase vzniku jeho teórie neboli ešte známe žiadne informácie o rozložení kladného a záporného náboja v atóme.
J.J.Thomson predpokladal, že atóm je kladne nabitá guľa, v ktorej sú náhodne rozptýlené záporne nabité elektróny. Predpokladal, že atóm má rozmer asi 10-10 m.
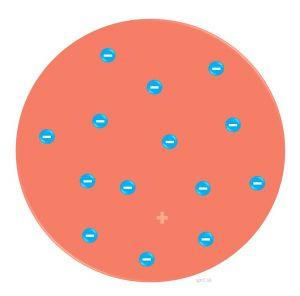
Rutherfordov (planetárny) model atómu
Už o niekoľko rokov neskôr, v roku 1911, vznikol Rutherfordov planetárny model atómu.
Rutherfordov usudzoval, že atóm sa skladá z malého hustého stredu kladne nabitých častíc a okolo neho sa pohybujú elektróny po obežných dráhach. Podobne, ako mesiace okolo planét.
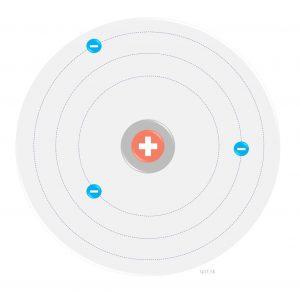
Bohrov model atómu
Ďalším v poradí bol Bohrov model, o ktorý sa v roku 1913 zaslúžil Niels Bohr.
Atóm považoval za stabilnú sústavu, ktorá sa skladá z jadra s kladným nábojom a z elektrónového obalu. Uvažoval, že takmer celá hmota atómu je sústredená v jeho jadre a že elektrón sa bez vyžarovania energie môže pohybovať len po určitých dráhach. Pri prechode elektrónu z jednej dráhy do druhej sa vyžiari energia.
Niels Bohr teda pracoval s energetickými hladinami elektrónov v atóme. Elektróny sú podľa tohto modelu vo vrstvách, z ktorých každá obsahuje ich pevný počet.
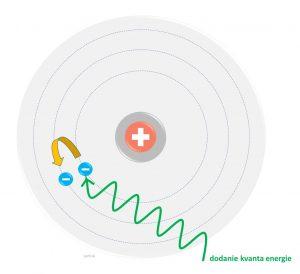
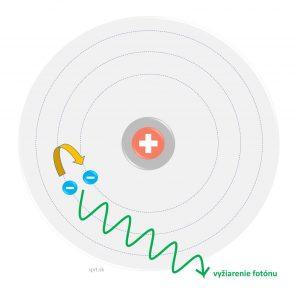
Atóm bol dlho považovaný za najmenšiu nedeliteľnú časticu
Koncom 19. storočia objavili fyzici v atóme ďalšie menšie častice – elektróny a začiatkom 20. storočia vedci dokázali, že v atóme je atómové jadro, ktoré obsahuje mikročastice – protóny a neutróny.
Dnes už vieme, že protóny a neutróny obsahujú ešte menšie častice – kvarky.
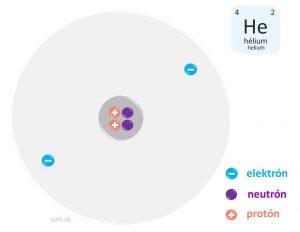
Atóm - čo o ňom vieme dnes
Každý prvok má charakteristické atómy.
Poznáme asi 92 rôznych druhov vyskytujúcich sa v prírode. Atóm je základnou časticou každej chemickej látky.
Atóm tvorí jadro a elektrónový obal.
Jadro s kladným nábojom je malé, ale ťažké.
V jadre sa nachádzajú protóny a neutróny, spoločným názvom – nukleóny (odvodené od latinského „nucleus“.
Základné častice atómu sú:
protón – má symbol p+
neutrón – má symbol n0
elektrón – má symbol e–
Protóny + neutróny = nukleóny.
Atóm, ako základná častica nemá žiadny náboj.
Atóm je neutrálny, pretože počet protónov v jadre je rovnaký ako počet elektrónov v jeho obale.
Možno si to ľahšie zapamätáš zapísané graficky.
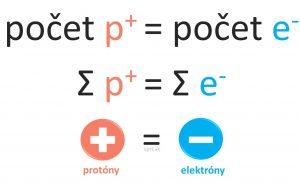
Elementárne častice atómu majú náboj:
protón – má kladný náboj (+1)
neutrón – má nulový náboj (0)
elektrón – má záporný náboj (-1).
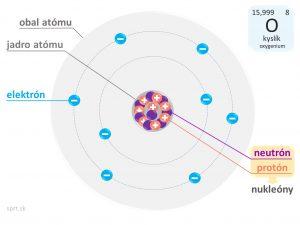
Jadro atómu
Nukleónové číslo (A) označuje počet všetkých nukleónov v jadre atómu. Je to súčet protónov a neutrónov v jadre atómu.
Jadro atómu obsahuje kladne nabité protóny a neutróny bez elektrického náboja, preto má jadro kladný náboj.
Okolo jadra obiehajú v jednotlivých vrstvách elektróny, ktorých počet vyjadruje protónové číslo (Z). Hovorí zároveň o počte protónov v jadre.
Atóm kyslíka: A = 15,999 (zaokrúhlene 16).
Atóm kyslíka: Z = 8.
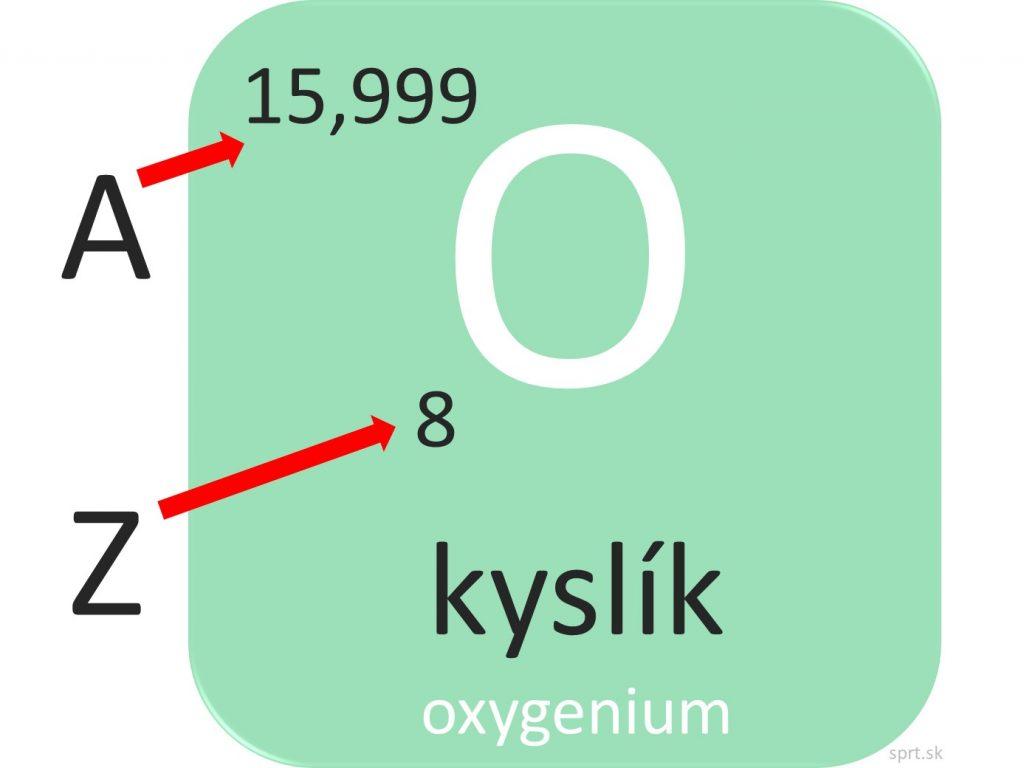
Príklad na atóme kyslíka ešte raz:
Ak A = 16 a Z = 8,
vieme, že atóm kyslíka má v jadre spolu 16 nukleónov, z čoho je 8 protónov a 8 neutrónov. Vieme tiež, že v obale atómu sa nachádza 8 elektrónov.
Elektróny na valenčných vrstvách, sa zúčastňujú tvorby väzieb s inými atómami pri chemických reakciách. Preto chemické aj fyzikálne vlastnosti prvku určuje počet valenčných elektrónov – elektrónov uložených na valenčnej vrstve.
Protónové a nukleónové číslo
TEXT PRE VÁS PRÁVE PRIPRAVUJEME
Elektrónový obal atómu
Elektrónový obal obsahuje elektróny ( e– ), preto má záporný náboj.
Pozostáva z elektrónových vrstiev, ktoré sa označujú písmenami K, L, M, N, O, P a Q.
Vrstva „K“ sa nachádza najbližšie k jadru a obsahuje najviac 2 elektróny.
Vrstva „L“ má najviac 8 elektrónov, atď. (obrázok pripravujeme)
Posledná vrstva, ktorá neobsahuje plný počet elektrónov, najviac vzdialená od jadra atómu, sa volá valenčná a obsahuje valenčné elektróny. Ich počet je u jednotlivých chemických prvkov rôzny.
Kvantovo-mechanický model atómu
Ďalšie skúmanie atómov prvkov ukázalo, že správanie elektrónov sa nedá popísať klasickou mechanikou. Preto vznikol kvantovo-mechanický model atómu.
Ten vychádza z kvantovej mechaniky, ktorej základy položili francúzsky fyzik L. de Broglie a rakúsky fyzik E. Schrödinger.
Elektrón môže mať vlastnosti častice, ale aj vlnové vlastnosti. Podľa Heisenbergovho princípu neurčitosti sa nedá presne určiť poloha aj rýchlosť elektrónov súčasne. Vďaka funkcii psí – Ψ – sa dá však vypočítať pravdepodobnosť, s akou sa elektrón bude v danom momente vyskytovať v určitej oblasti atómu. Grafickým znázornením je orbitál, v ktorom je výskyt elektrónu najviac pravdepodobný. Pozri aj elektrónová konfigurácia.
Čo je kvantová mechanika
Kvantová mechanika je oblasť fyziky. Skúma a popisuje javy na nanoúrovni. Zaoberá sa skúmaním správania atómov, molekúl, atómových jadier, teda objektov veľkých asi 10-6 až 10-13m. Keď to zapíšeme tradičným spôsobom, vyzerá to takto: 0,000001 m – 0,0000000000001 m. Ešte stále nemáš predstavu? Ako vyzerá 1mm na školskom pravítku vieš, no a to je 0,001 m.
Kvantová fyzika dostala svoj názov podľa toho, že hodnoty niektorých fyzikálnych veličín sa nemenia spojito, ale v skokoch po určitých množstvách – tzv. kvantách.
Zaujímavosti...
Atóm v porovnaní s 1mm čiarou je asi tak veľký, ako keby sme porovnávali list papiera s Empire State Building.
Do priemeru jedného vlasu sa vojde pol milióna atómov.
Keby sme jablko zväčšili do veľkosti Zeme, každý z atómov vodíka by mal veľkosť jablka.
Na povrchu špendlíkovej hlavičky s priemerom maximálne pár milimetrov sa nachádza asi 5 biliónov (5 000 000 000 000) atómov.
Zrnko piesku pozostáva z 2,2 triliónov atómov (2 200 000 000 000 000 000),
ľudská červená krvinka z 10 biliónov atómov (10 000 000 000 000),
bodka za vetou z 5 biliónov (5 000 000 000 000).
Keby si niekto chcel zahrať futbal s atómom, musel by ho najprv 1,5 miliárdkrát zväčšiť.
Keby sa aj on sám zväčšil v tomto pomere, bol by vysoký asi 2,5 miliónov kilometrov (to je skoro ako dve slnká na sebe) a vážil by viac, ako populácia Číny a Indie dokopy.
V našom tele je približne 1000 krát viac atómov, ako hviezd vo vesmíre.
Zdroje:
HAŠKOVEC, MŰLLER. 2006. Galéria géniov. Bratislava. PRÍRODA
HAVRILA a spol. 2004. Ľudia, ktorí zmenili svet. Praha. OTTOVO NAKLADATELSTVÍ
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
LEVY. 2012. Boeing v pavoučí síti a dalších 99 vědeckých analogií. Praha. GRADA