V tomto článku si povieme o zlúčeninách halogénov.
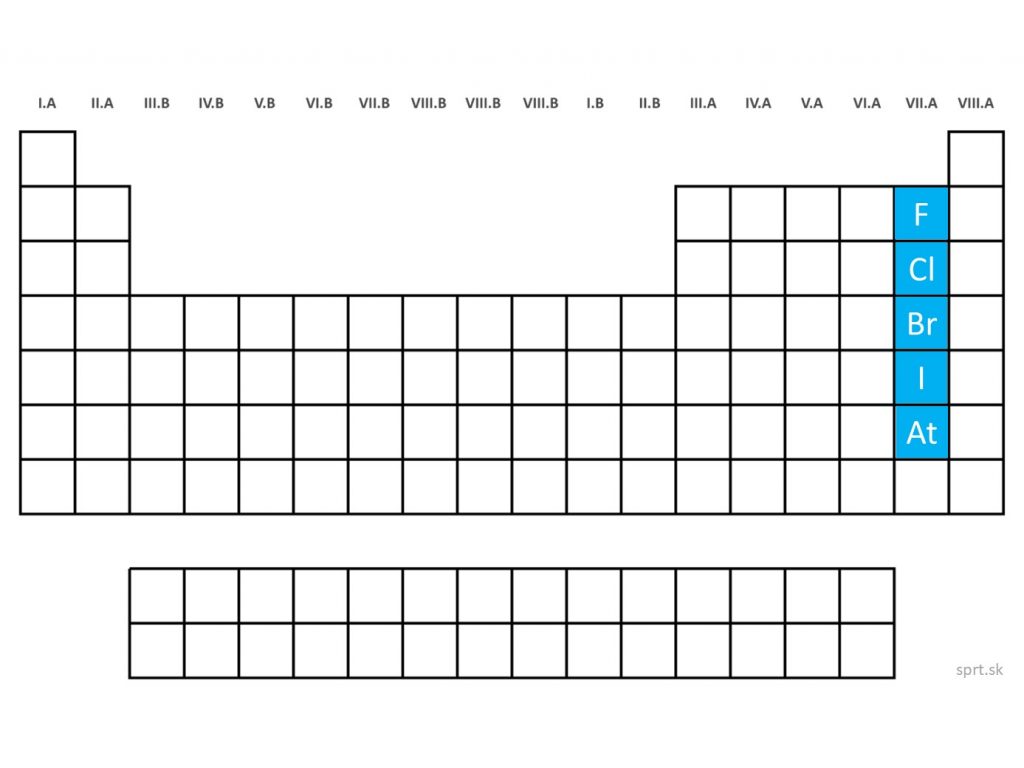
Halogény sa nachádzajú v VII.A skupine periodickej sústavy prvkov.
Sú to: fluór (F), chlór (Cl), bróm (Br), jód (I) a astát (At).
Halogénvodíky
Halogénvodíky sú zlúčeniny, ktoré vznikajú priamym zlučovaním halogénu s vodíkom, alebo neutralizáciou.
Sú to bezfarebné plyny s charakteristickým zápachom, ktoré tvoria jednu kovalentnú väzbu.
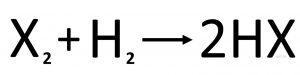
Fluorovodík (HF)
– v roztoku kyselina fluorovodíková – je stredne silná kyselina vytvárajúca vodíkové väzby.
Uchovávame ju v plastových nádobách, pretože leptá sklo.
Chlorovodík (HCl)
– kyselina chlorovodíková, alebo tiež kyselina soľná. Bežne býva koncentrovaná (36-38%).
Veľký význam má pri trávení a v chemickom priemysle.
Bromovodík (HBr)
– kyselina bromovodíková je silnejšia kyselina ako HCl – koncentrácia 48%.
Halogenidy
Halogenidy sú binárnymi zlúčeninami halogénov – obsahujú dva rôzne prvky: jeden anión a jeden katión.
Halogenidy sú soli odvodené od halogénvodíkov.
Pripravujú sa priamym zlučovaním, neutralizáciou, alebo reakciou halogénvodíka s kovom.
Delíme ich na tri skupiny:
– iónové
– molekulové
– s reťazcovou štruktúrou.
Fluorid sodný (NaF)
– je anorganická zlúčenina fluóru a sodíka.
Používa sa pri prevencii zubného kazu a terapii osteoporózy. Pri nadbytku je škodlivý.
Chlorid sodný (NaCl)
– poznáme ho aj pod názvom kuchynská soľ. Je to anorganická zlúčenina chlóru a sodíka.
Okrem gastronómie sa využíva aj v zdravotníctve alebo ako konzervačný prostriedok v potravinárstvom priemysle.
Bromid draselný (KBr)
Bromid strieborný (AgBr)
–anorganické zlúčeniny brómu a draslíka, alebo striebra.
Využívajú sa vo fotopriemysle.
Bromid strieborný sa pri priamom pôsobení svetla rozkladá na striebro (Ag) a bróm (Br).
Bromid sodný (NaBr)
Bromid vápenatý (CaBr)
– používajú sa v medicíne ako sedatíva.
Jodid draselný (KI)
– je anorganická zlúčenina jódu a draslíka.
Je mierne dráždivý – pri práci s ním treba používať ochranné rukavice.
Používa sa v potravinárstve, ako zložka dezinfekčných prostriedkov, ale aj v biomedicíne. Doma sa môžete stretnúť s jodidovanou kuchynskou soľou.
Vplýva na účinnosť štítnej žľazy.
Oxidy
Oxidy sú dvojprvkové zlúčeniny kyslíka s iným prvkom. Vo väčšine prípadov sú nestále.
Výnimkou je fluorid kyslíka, pretože fluór má vyššiu elektronegativitu ako kyslík.
Delíme ich na tri skupiny:
– iónové
(atóm kyslíka je viazaný iónovou väzbou s katiónom kovu – hlavne alkalické kovy, kovy alkalických zemín)
– atómové
(s prvkami zo stredu periodickej tabuľky – atómy sú viazané kovalentnými väzbami)
– molekulové
(s polokovmi a kovmi – atómy sú viazané kovalentnými väzbami)
Viac o chemických väzbách a oxidoch.
Kyslíkaté kyseliny
Kyslíkaté kyseliny halogénov sú silné oxidačné činidlá. Okrem fluóru ich dokáže tvoriť každý prvok tejto skupiny. Všetky kyslíkaté kyseliny s chlórom zaraďujeme medzi silné kyseliny.
kyselina chlórna (HClO)
– je to nestála kyselina, rýchlo sa mení.
Odvodzujeme z nej soli – chlórnany. Tie sa využívajú na výrobu výbušnín a zápaliek.
Zdroje: školské poznámky šprta