Napriek tomu, že si to neuvedomujeme, sú všade. Prebiehajú stále. Okolo, aj priamo v nás.
Chemické reakcie sú deje, pri ktorých reaguje jedna alebo viacero látok za vzniku jedného alebo viacerých produktov. Pri reakcii sa mení chemické zloženie aj štruktúra hmoty, pôvodné väzby zanikajú a vznikajú nové.
Atómy pri chemickej reakcii nevznikajú, ani nezanikajú. Ide len o ich zlučovanie, oddeľovanie, alebo ich preskupovanie.
Reaktant a produkt
Látky, ktoré vstupujú do chemickej reakcie, nazývame reaktanty. V novej terminológii sa označujú aj ako edukty.
Najčastejšie sú aspoň dva, existujú však aj reakcie, v ktorých je jeden reaktant. Môžu nimi byť prvky, alebo zlúčeniny. Tieto reaktanty navzájom reagujú, štiepia sa ich chemické väzby, mení sa ich štruktúra.
Výsledkom chemickej reakcie sú nové chemické väzby v produktoch.

Zákon zachovania hmotnosti
Pri každej reakcii platí zákon zachovania hmotnosti.
Ten hovorí, že počet a druh atómov reagujúcich látok sa pri reakcii nemení. Každý atóm, ktorý bol súčasťou reaktantov, je aj súčasťou produktov. Platí to i v prípade, že pri reakcii sa uvoľnilo teplo.
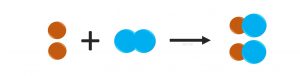
Atómy pri chemickej reakcii nevznikajú, ani nezanikajú. Len sa zlučujú, oddeľujú alebo ich preskupujú.
Typy chemických reakcií
Rozlišujeme tri základné typy chemických reakcií.
Chemická syntéza (zlučovanie)
Naopak, chemická syntéza alebo chemické zlučovanie je proces, počas ktorého sa viac jednoduchších reaktantov zlučuje za vzniku zložitejšieho produktu.
Inak povedané, z jednoduchších látok vzniká látka zložitejšia.
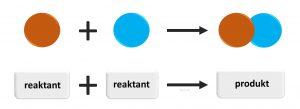
Chemický rozklad (analýza)
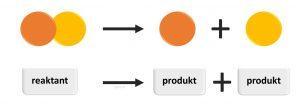
Pri chemickom rozklade sa jeden zložitý reaktant rozkladá na viacero jednoduchých produktov.
Inak povedané, zo zložitejšej látky vznikajú látky jednoduchšie.
Substitučná reakcia (nahradzovanie, zámena)
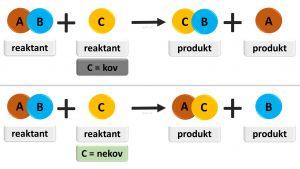
Substitučná reakcia je charakteristická tým, že sa nahrádza jeden alebo viacero atómov rovnakého typu iným typom atómov druhej látky a vznikajú nové zlúčeniny.
Celkový počet častíc sa v priebehu chemickej reakcie nemení.
Výmenná reakcia
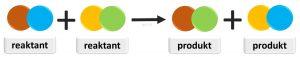
Výmenné reakcie sú reakcie medzi dvoma zlúčeninami, ktoré si navzájom vymieňajú svoje zložky.
Pri podvojnej zámene sa obidve východisková látky rozkladajú a vznikajú nové zlúčeniny.
Zápis chemickej reakcie
Deje, ktoré prebiehajú počas chemických reakcií zapisujeme chemickými rovnicami.
Vzorce reaktantov píšeme na ľavú, vzorce produktov na pravú stranu rovnice. Šípka ukazuje smer, ktorým chemická reakcia prebieha. Rovnica môže obsahovať aj ďalšie informácie o jednotlivých látkach, ako napríklad skupenstvo, alebo počet molekúl.
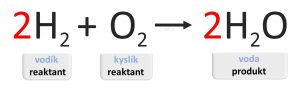
Pri písaní chemických rovníc vždy platí, že prvky zapisujeme značkami a zlúčeniny vzorcami. Šípka smeruje od reaktantov k produktom. Počet atómov každého druhu musí byť na oboch stranách rovnice zhodný. Ak nie je, je nutné ho dorovnať pomocou stechiometrických koeficientov.
Často v reakciách označujeme aj skupenstvo jednotlivých zložiek pomocou symbolov v zátvorkách:
(g) = plynné skupenstvo,
(s) = pevné skupenstvo,
(l) = kvapalné skupenstvo a (aq) = vodný roztok.
Chemická rovnica rešpektuje vždy zákon zachovania hmotnosti, energie, aj zákon stálych zlučovacích pomerov. To znamená, že hmotnosť všetkých reaktantov je rovnaká, ako hmotnosť produktov, energia izolovanej sústavy je v priebehu reakcie konštantná a pomer prvkov, alebo súčastí zlúčeniny je vždy rovnaký.
Rozdelenie chemických reakcií
Chemické reakcie rozdeľujeme podľa určitých kritérií do skupín:
– podľa vonkajších zmien pri reakcii
– podľa druhu prenášaných častíc
– podľa spôsobu štiepenia väzieb
– podľa reakčného mechanizmu.
Viac sa o rozdelení chemických reakcií dočítaš v samostatnom článku TU.
Zdroje:
BELANOVÁ a spol. 2013. Školská encyklopédia biológie, chémie a fyziky. Bratislava. PRÍRODA
ADAMKOVIČ, ŠIMEKOVÁ, PROKŠA. 2009. Chémia pre 9. ročník základných škôl. Bratislava. Slovenské pedagogické nakladateľstvo – Mladé letá
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
z poznámok šprta