Chalkogény
Chalkogény, alebo prvky VI.A skupiny majú šesť valenčných elektrónov.
Patria sem kyslík, síra, selén, telúr a polónium.
Všetky majú viacero izotopov. Kyslík sa od zvyšných prvkov v tejto skupine výrazne líši, ostatné sú si svojimi vlastnosťami podobné.
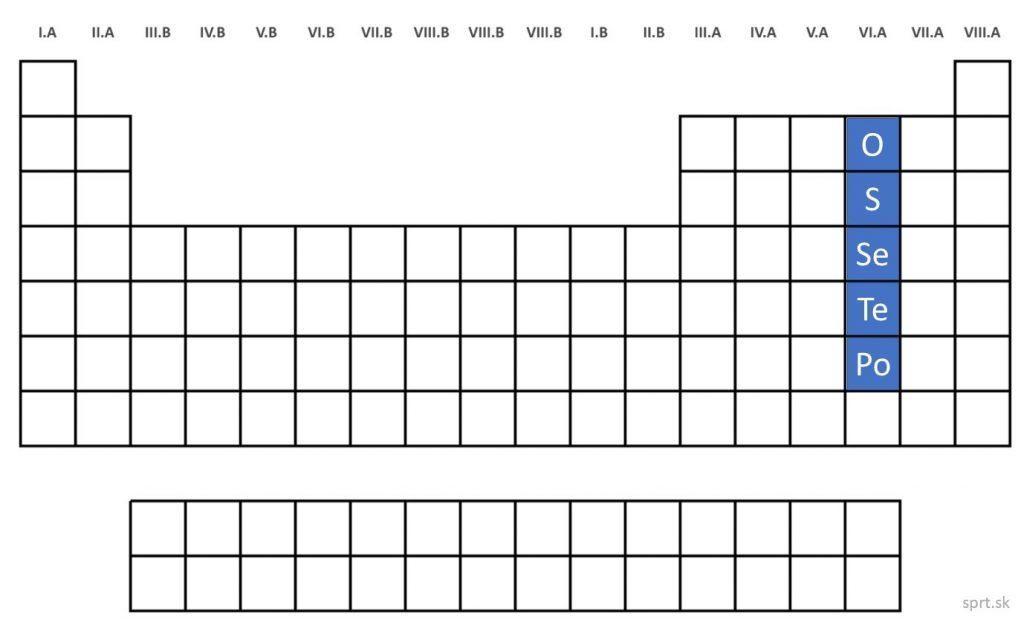
S rastúcim protónovým číslom týchto prvkov rastie aj ich kovový charakter:
– kyslík a síra sú nekovy,
– selén a telúr polokovy a
– polónium je kov.
Stabilnú elektrónovú konfiguráciu získavajú prijatím dvoch elektrónov za vzniku aniónu. Tvoria dvojitú, alebo dve jednoduché kovalentné väzby. Na ich tvorbu používajú aj d-orbitály (okrem kyslíka).
Pri bežných podmienkach sú celkom stále, ak zvýšime teplotu, reagujú s väčšinou prvkov. Po zapálení zhoria na oxidy. Po zahriatí reagujú s väčšinou kovov za vzniku selenidov, sulfidov a teluridov.
Popis jednotlivých prvkov
Kyslík - O (Oxygenium)
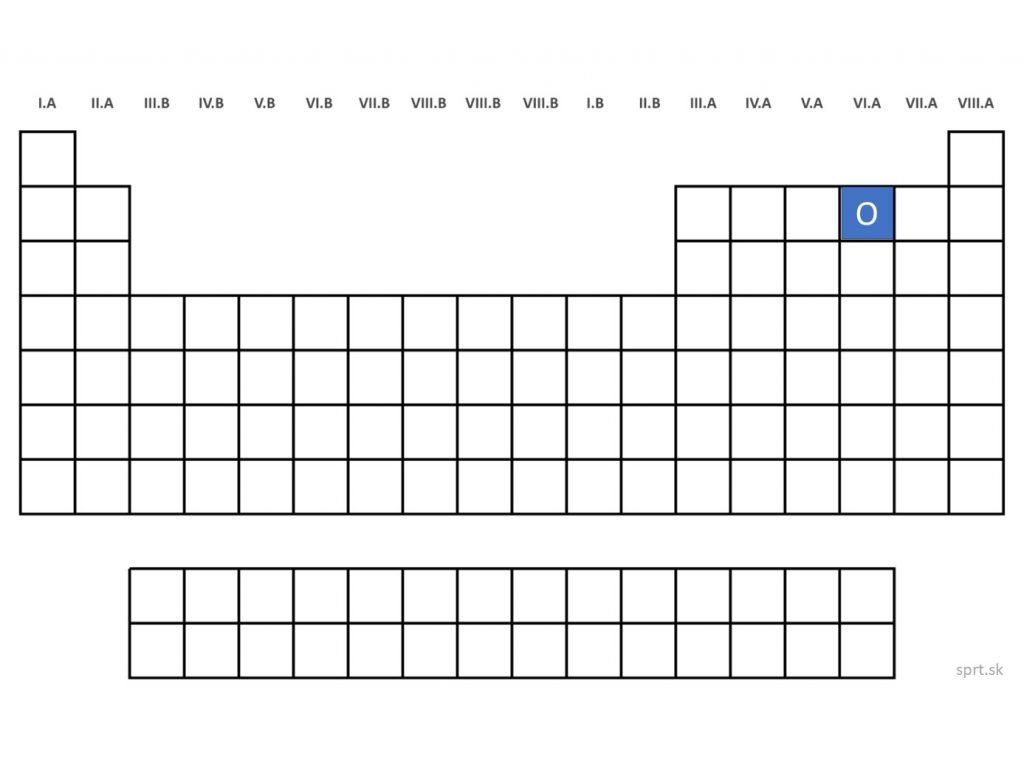
Kyslík sa svojimi vlastnosťami výrazne líši od zvyšku skupiny. Má tri izotopy, za normálnych podmienok sa vyskytuje v atmosfére v plynnom skupenstve a je najrozšírenejším prvkom na Zemi.
V prírode sa vyskytuje vo forme dvojatómových molekúl (viď obrázok).

Je bezfarebný a ťažší ako vzduch. V kvapalnom a tuhom skupenstve má modrú farbu. Nie je horľavý, no podporuje horenie. Je štvorväzbový, vyskytuje sa do forme dikyslíka (O2) a trikyslíka (O3), ktorý poznáme ako ozón. Väčšinou sa zlučuje priamo, jeho reakcie sú exotermické (vydávajú energiu).
V laboratórnych podmienkach sa vyrába termickým rozkladom oxidov ťažkých kovov, solí, oxokyselín, katalyckým rozkladom peroxidu vodíka, alebo elektrolýzou vody. V priemyselnej výrobe sa získava frakčnou destiláciou skvapalneného vzduchu, alebo elektrolýzou vody.
Kyslík je univerzálnym oxidovadlom, vždy nadobúda oxidačné čísla –I a –II, okrem zlúčenín s fluórom. Tam má jeho oxidačné číslo hodnotu +II, keďže fluór má ako jediný vyššiu elektronegativitu.
Využíva sa v zdravotníctve (lekárske použitie, operácie, inhalácia pri pľúcnych ochoreniach), alebo na dýchanie napr. pri potápaní. V kvapalnej forme je použiteľný ako palivo.
Je makrobiogénnym prvkom. Nachádza sa vo vzduchu, je zdrojom energie a takisto súčasťou mnohých zlúčenín.
Ozón
(O3)
Ozón sa nachádza v hornej časti atmosféry, kde vytvára ozónovú vrstvu. Tá bráni vniknutiu škodlivých častí UV žiarenia (UV-A je v malej miere potrebné, UV-B je škodlivé, UV-C je taktiež škodlivé, ale zachytáva ho kyslík). V nižších oblastiach je jedovatý.
Má plynné skupenstvo a modrú farbu. Dokáže sa premeniť aj na kvapalnú alebo tuhú látku.
Má silné oxidačné účinky, molekula je lomená.
Vzniká pri elektrochemických výbojoch v atmosfére.
Používa sa v medicíne na sterilizáciu, vďaka silným oxidačným účinkom nachádza použitie aj v papierenskom priemysle. Okrem toho sa využíva na dezinfekciu, keďže má antibakteriálne účinky.
Síra - S (Sulphur)
Síra je žltá kryštalická látka, vo vode sa nerozpúšťa. Rozlišujeme síru alfa a síru beta.
Je 6-väzbová, rozpustná v nepolárnych rozpúšťadlách, pomerne stála. Pri zvýšenej teplote reaguje s väčšinou prvkov, vie redukovať aj oxidovať.
Patrí medzi prvky s vyššou elektronegativitou. Nie je dobrým vodičom tepla, ani elektriny.
V prírode sa vyskytuje vo viacerých formách – elementárna, viazaná v sulfidoch a síranoch (napr. pyrit), alebo viazaná v bielkovinách. Nájdeme ju aj v rope, často znečisťuje fosílne palivá.
Používa sa pri výrobe zápaliek, rôznych zlúčenín a prostriedkoch proti rastlinným škodcom. Rovnako ako kyslík patrí medzi biogénne prvky, je súčasťou aminokyselín a vitamínov.
Selén - Se (Selenium)
Selén je pevná kryštalická látka, ktorej zlúčeniny sú toxické.
Je 6-väzbový. Má svetlovodivé vlastnosti a zaraďuje sa aj medzi biogénne prvky.
Podieľa sa na tvorbe svalov, jeho účinky sú dôležité pre krvný obeh a pôsobí ako antioxidant. Pri jeho nedostatku v tele dochádza k degenerácii pečene a svalov.
Je podobný síre, má až 6 alotropických modifikácií.
Nachádza sa v morských živočíchoch. Využíva sa vo fotočlánkoch a polovodičoch, takisto na farbenie skla.
Spolu s telúrom často v prírode sprevádzajú síru v jej zlúčeninách a takisto sú ich reakcie a reakcie síry veľmi podobné. Stabilita týchto dvoch prvkov je ale menšia.
Telúr - Te (Tellurium)
Telúr je 6-väzbový polovodič, jeho čistá forma aj zlúčeniny sú toxické.
Modifikáciami je podobný selénu.
Polónium - Po (Polonium)
Polónium je kov, vyskytuje sa v uránových rudách.
Všetky jeho izotopy sú rádioaktívne.
Je ušľachtilejším prvkom ako striebro, je toxický.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
DVOŘÁČKOVÁ. 2013. Chemie pro každého. Olomouc. Rubico