Chemická rovnováha... alebo "Tam sa nič nedeje!"
„Tam sa nič nedeje!“
„Deje, ale priama aj spätná reakcia prebiehajú rovnako rýchlo, preto zmenu nepozorujeme.“
Chemická rovnováha je stav, kedy chemická sústava už nemení svoje zloženie, ak sa nemenia vonkajšie podmienky.
Chemická rovnováha - čo to presne znamená
Rovnovážny stav, teda chemická rovnováha, nastáva medzi reaktantmi a produktmi a znázorňujeme ho protismernými šípkami. Počas tohto stavu prebiehajú reakcie oboma smermi súčasne – reakcia priama i spätná – a rovnakou rýchlosťou. Chemické deje prebiehajú neustále, no svojimi účinkami sa rušia. Jedná sa teda o dynamickú rovnováhu.
Na začiatku, keď sú prítomné iba reaktanty (látky alebo prvky vstupujúce do chemickej reakcie), rýchlosť priamej reakcie je vyššia. V priebehu reakcie sa však rýchlosti vyrovnávajú, zmenšuje sa rýchlosť priamej a zvyšuje sa rýchlosť spätnej reakcie. Keď sa rýchlosti oboch reakcií vyrovnajú, sústava sa nachádza v stave dynamickej rovnováhy.
Guldberg-Waageho zákon
Guldberg-Waageho zákon chemickej rovnováhy vyjadruje rovnovážnu konštantu reakcie. Hovorí, že podiel súčinu číselných hodnôt rovnovážnych koncentrácií produktov umocnených príslušnými stechiometrickými koeficientmi a súčinu číselných hodnôt rovnovážnych koncentrácií reaktantov umocnených príslušnými stechiometrickými koeficientmi je konštantný.
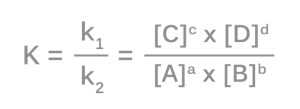
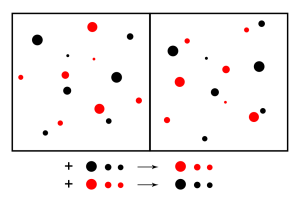
Podľa princípu akcie a reakcie je vonkajším narušením rovnováhy – akciou – vyvolaná reakcia, ktorá vedie k zrušeniu účinku vonkajšieho zásahu.
Keď rovnováhu naruším, buď sa zväčší počet reaktantov, alebo produktov. Tento princíp sa nazýva princípom pohyblivej rovnováhy. Chemickú rovnováhu môžem ovplyvniť niekoľkými faktormi – teplotou, tlakom (pri plynoch) a koncentráciou reaktantov, alebo produktov.
Koncentrácia látok
Keď pridám reaktanty, reakcia sa opätovne rozbehne a zväčší sa počet produktov. V tomto prípade hovoríme, že rovnováha sa posunie na stranu produktov. Naopak, keď reaktanty z reakcie odoberiem, rovnováha sa posunie na ich stranu.
Keď odoberiem produkty, rovnováha sa posunie na stranu produktov. Vznikne ich viac, pretože ich odobratím vznikne miesto pre nové. V prípade, že produkty pridám, rovnováha sa posunie na stranu reaktantov.
Rovnovážna konštanta sa nemení.
Teplota
Pri teplote a posunoch rovnováhy ňou spôsobených musíme brať do úvahy, či je reakcia exotermická, alebo endotermická. Touto oblasťou chémie sa zaoberá termochémia.
Keď v endotermickej reakcii zvýšim teplotu, rovnováha sa posunie na stranu produktov. No ak zvýšim teplotu pri exotermickej reakcii, rovnováha sa presunie sa stranu reaktantov.
Pri teplote sa ukazuje aj spojenie s koncentráciou látok. Zvýšením teploty sa koncentrácia látky zvýši v smere endotermického deja, znížením teploty sa koncentrácia zníži v smere exotermického deja.
Tlak
Tlak vplýva na rovnováhu reakcie len v prípade, že všetky látky v nej sú plynného skupenstva a látkové množstvo reaktantov sa nerovná látkovému množstvu produktov.
Napríklad v reakcii H2 (g) + I2 (g) → 2HI (g) by tlak rovnováhu neovplyvnil, pretože látkové množstvo reaktantov je rovnaké, ako látkové množstvo produktov.
Naopak pri reakcii N2 (g) + 3H2 (g) → 2NH3 (g) je látkové množstvo reaktantov 4 moly, zatiaľ čo pri produktoch 2 moly. V tomto prípade by teda tlak rovnováhu v reakcii ovplyvnil.
Zvýšením tlaku sa rovnováha posunie na stranu, kde je menšie látkové množstvo. Pri znížení tlaku sa rovnováha posunie v smere väčšieho látkového množstva.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
KMEŤOVÁ a spol. 2010. Chémia pre 1. ročník GŠŠ a 5. ročník GOŠ. EXPOL PEDAGOGIKA