Vzácne plyny
Vzácne plyny sú stabilné, nezlučujú sa.
Ale poďme postupne.
Chemické prvky patriace do skupiny vzácnych plynov – hélium, neón, argón, kryptón, xenón a radón – sa nachádzajú v poslednej skupine periodickej tabuľky prvkov, teda v VIII.A skupine.
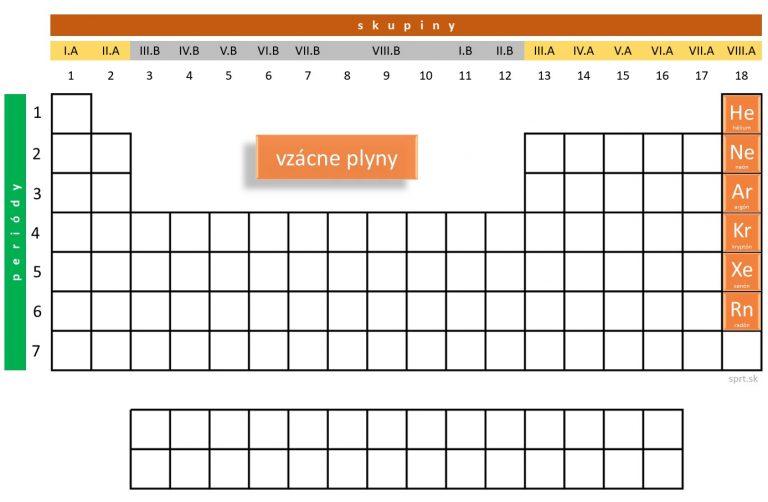
Všetky okrem hélia majú na valenčnej vrstve osem elektrónov, majú dobudovanú valenčnú vrstvu. To je príčina ich inertnosti, čo znamená, že sú chemicky nereaktívne. Za bežných podmienok teda nereagujú, sú stabilné.
Informácie o dôležitosti valenčnej vrstvy sa dočítaš v článku o elektrónovej konfigurácii.
Prvky tejto skupiny patria medzi neprechodné prvky. Znamená to, že ich atómy netvoria dvojatómové molekuly a že sa v plynnom stave nachádzajú ako samostatné atómy.
Vzácne plyny - viac o jednotlivých prvkoch
Hélium - He (lat. helium)
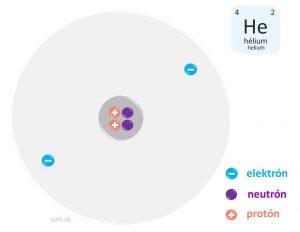
 Hélium, na rozdiel od ostatných vzácnych plynov má na valenčnej vrstve iba dva elektróny.
Hélium, na rozdiel od ostatných vzácnych plynov má na valenčnej vrstve iba dva elektróny.
Objavené bolo v roku 1868.
Ako prvý ho objavil francúzsky astronóm Pierre Jules César Janssen, ktorý v auguste 1868 sledoval v Indii zatmenie Slnka. K rovnakému výsledku v tom istom roku dospel pri pozorovaní slnečnej koróny aj Angličan Norman Lockyer.
Názov Hélium je odvodené z gréckeho „helios“, čo v preklade znamená Slnko. Pomenovali ho tak preto, že prvý raz bolo objavené na Slnku. Najskôr si vedci mysleli, že sa tento plyn nachádza len na Slnku.
V roku 1882 ho detekoval taliansky fyzik Luigi Palmieri aj na Zemi, a to pri analýze lávy po výbuchu sopky Vezuv. Izoloval ho však až Škót Wiliam Ramsay v roku 1895. Objavil ho v uránovom mineráli cleveite. Ako to vo vede väčšinou býva, objavil ho náhodou, pri hľadaní iného plynu – argónu.
Dnes už vieme, že sa nachádza v atmosfére aj v niektorých rádioaktívnych horninách.
Hélium - čím je charakteristické
Hélium je plyn.
Na valenčnej vrstve má iba dva elektróny.
Je bezfarebný, bez chuti, bez zápachu.
Chemicky je úplne inertný – znamená to, že sa nezlučuje. Nie sú známe žiadne jeho chemické zlúčeniny.
Hélium a jeho využitie
Pretože má extrémne nízku hustotu a inertné správanie, používa sa na plnenie balónov a vzducholodí, ako náhrada za vysoko horľavý vodík. Používa sa aj v žiarovkách a laseroch, slúži aj pri určovaní veku hornín.
Využíva sa aj v zdravotníctve, napríklad v tomografii pri diagnostikovaní rôznych ochorení.
Využíva sa aj na dosiahnutie veľmi nízkych teplôt. Obrovský význam má ako chladiace médium vo Veľkom hadrónovom urýchľovači (LHC) pri Ženeve. Ak ťa zaujíma, čo presne sa v atómovom urýchľovači deje, pozri si video.
Neón - Ne (Neon)

Neón bol objavený roku 1898, jeho názov znamená „nový“.
Vyskytuje sa v atmosfére a niektorých rádioaktívnych horninách. Používa sa v žiarovkách a laseroch.
Na valenčnej vrstve má všetkých 8 elektrónov.
Argón - Ar (Argon)

Argón je zo všetkých prvkov spomedzi tejto skupiny najzastúpenejším v atmosfére – približne 1%. Okrem toho sa nachádza v niektorých rádioaktívnych horninách.
S héliom tvorí ochranný plyn pri zváraní niektorých kovov zabraňovaním kontaktu látok so vzduchom – bráni oxidácii. Používa sa aj v laseroch a žiarovkách.
Na valenčnej vrstve má všetkých 8 elektrónov.
Kryptón - Kr (Krypton)

Kryptón je ešte zriedkavejší ako neón a pomenovaný je podľa slova „skrytý“. Okrem atmosféry a rádioaktívnych hornín ho môžeme nájsť aj vo fluoridoch.
Na valenčnej vrstve má všetkých 8 elektrónov.
Xenón - Xe (Xenon)

Xenón je veľmi ťažký, keby sme ním naplnili balón, padal by nadol.
Jeho názov v preklade znamená „cudzí“.
Rovnako ako všetky vzácne plyny, nachádza sa v atmosfére a niektorých rádioaktívnych horninách. Okrem toho dokáže vytvárať zlúčeniny s fluórom – fluoridy.
Na valenčnej vrstve má všetkých 8 elektrónov.
Radón - Rn (Radon)

Radón je jediným rádioaktívnym prvkom z tejto skupiny.
Vzniká pri rozpade uránu a používa sa pri liečbe rakoviny.
Vyskytuje sa v atmosfére a rádioaktívnych horninách, dokáže tvoriť fluoridy a využíva sa aj v žiarovkách a laseroch.
Na valenčnej vrstve má všetkých 8 elektrónov.
Vzácne plyny - kde ich nájdeme
V malom množstve sa všetky vzácne plyny vyskytujú v atmosfére, často sú produktami rádioaktívneho rozpadu nerastov. Za bežných podmienok sú plynné a majú vysokú ionizačnú energiu.
Dokážeme ich získať ako vedľajšie produkty pri frakčnej destilácii kvapalného vzduchu. Hélium sa dá získať zo zemného plynu.
Vzácne plyny a ich využitie
Keď vzácne plyny zahrejeme, žiaria špecifickými farbami.
Používajú sa ako náplne do žiariviek a výbojok. Elektrické výbojky naplnené týmito plynmi vydávajú charakteristické svetlo. To vzniká prechodom elektrického prúdu trubicou, v ktorej sa nachádza daný plyn. Pri odtrhnutí elektrónov sa uvoľňuje svetlo.
Vzácne plyny - zhrnutie na záver
Vzácne plyny sú stabilné, nezlučujú sa.
Keď vzácne plyny zahrejeme, žiaria špecifickými farbami. Preto sa využívajú ako náplne do žiariviek a výbojok.
Elektrické výbojky naplnené týmito plynmi majú charakteristickú farbu svetla podľa toho, akým plynom sú naplnené.
Toto svetlo vzniká prechodom elektrického prúdu plynom v trubici, kde dochádza k odtrhnutiu elektrónu.
Napíš do komentáru
Čo urobí vdýchnutie hélia s ľudskými hlasivkami ?
Zdroje:
BELANOVÁ a spol. 2013. Školská encyklopédia biológie, chémie a fyziky. Bratislava. PRÍRODA
KUPKA. 2010. Periodická sústava prvkov. Praha. kupka
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
www.universetoday.com
školské poznámky šprta