Periodická sústava prvkov
je zobrazená v tabuľke, kde sa nachádzajú všetky dosiaľ známe chemické prvky, podľa periodického zákona (vlastnosti prvkov sú periodickou funkciou ich protónového čísla).
Jej zostavenie sa pripisuje ruskému vedcovi D.I. Mendelejovovi, podľa ktorého je Perodická sústava prvkov pomenovaná. V roku 1869 prvý raz uverejnil článok, v ktorom vysvetlil svoj vlastný systém usporiadanie chemických prvkov podľa ich atómovej hmotnosti. Na prvé miesto dal najľahší vodík (H), na posledné vtedy najťažší známy prvok urán. Tabuľka mala vtedy len 63 prvkov. Medzi nimi však Mendelejev vynechal prázdne miesto pre ďalšie prvky, ktorých existenciu už vtedy predpokladal. Viac o tomto géniovi a jeho objavoch sa dozvieš TU.
Celkový počet dnes známych prvkov je 118, z čoho 90 sa vyskytuje v prírode.
Najnovšie 4 prvky boli objavené len nedávno, roku 2016 a vedci predpokladajú objav ďalších prvkov.
Periódy
Periodická sústava prvkov obsahuje jednotlivé prvky, ktoré sú usporiadané do 7 vodorovných radov – periód, a to podľa rastúceho protónového čísla. Označené sú arabskými číslicami 1 – 7.
Číslo periódy určuje počet elektrónových vrstiev!
Tvar tabuľky a dĺžka periódy je taká, že prvky s podobnými vlastnosťami sú pod sebou.
Skupiny
V tabuľke nájdete aj osemnásť zvislých stĺpcov. Nazývame ich skupiny.
Delia sa na:
hlavnú skupinu (s, p-prvky), do ktorej patria neprechodné prvky a označujeme ju A-skupina. Číslo v označení skupiny I.A – VIII.A, udáva počet valenčných elektrónov atómu (výnimkou je He) a
vedľajšiu skupinu (d-prvky), v ktorej sú prechodné prvky, s označením B-skupina – I.B až VIII.B.
V nových tabuľkách sa zvykne používať už len označovanie 1 – 18, bez rozdelenia na skupiny A a B.
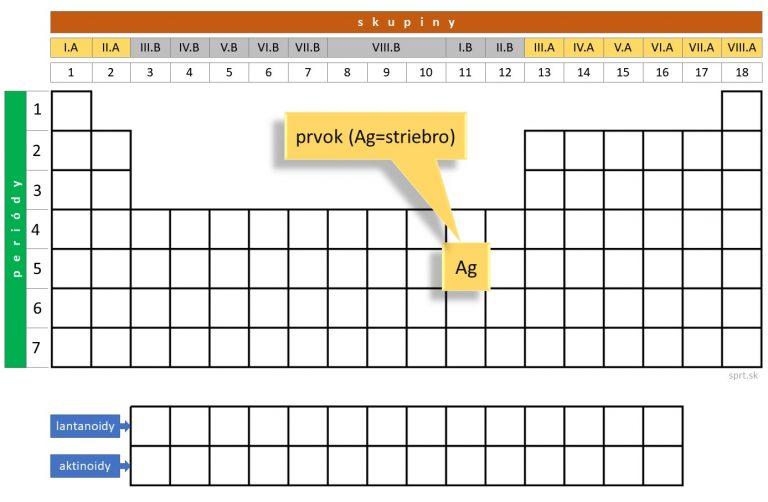
Lantanoidy a aktinoidy
Aby tabuľka nebola príliš dlhá, vyčleňujú sa z nej lantanoidy a aktinoidy (f-prvky), ktoré sa zobrazujú pod ňou a patria medzi vnútorne prechodné prvky.
Skupinové označenia
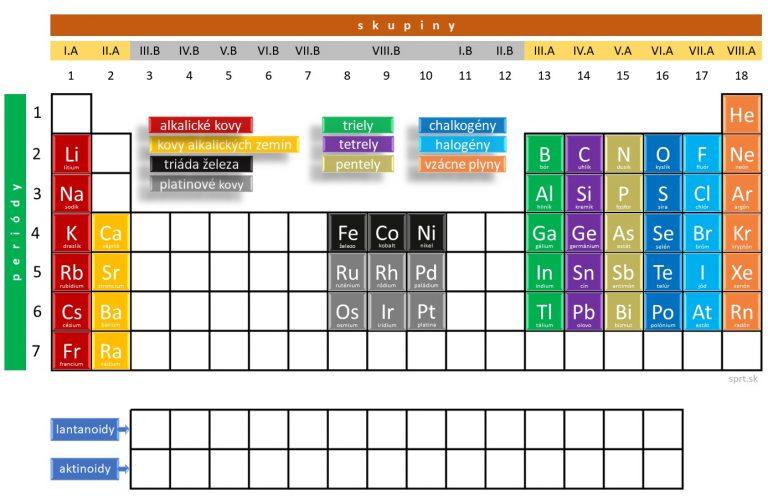
Niektoré skupiny prvkov majú svoje skupinové označenia. Názvy jednotlivých skupín a ich umiestnenie v periodickej tabuľke vidíš na obrázku nižšie.
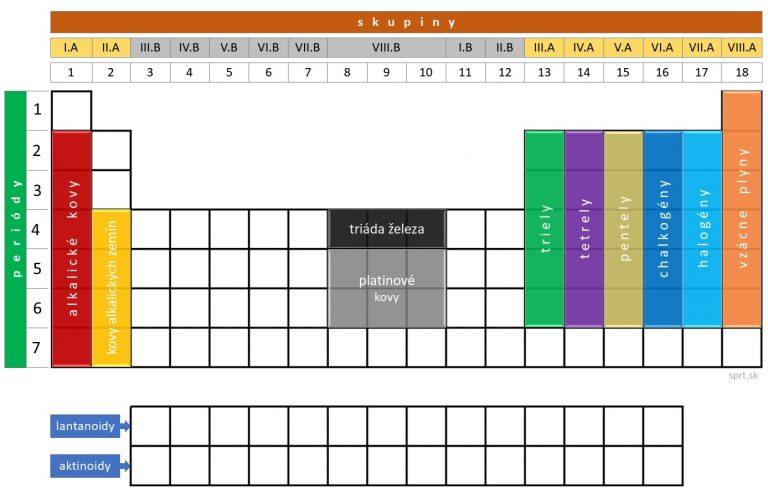
Patria sem:
– alkalické kovy (I.A – okrem H),
– kovy alkalických zemín (II.A – okrem Be a Mg),
– triely (III.A),
– tetrely (IV.A),
– pentely (V.A),
– chalkogény (VI.A),
– halogény (VII.A) a
– vzácne plyny (VIII.A).
Medzi skupinové označenia patrí tiež:
– triáda železa (Fe, Co, Ni)
– platinové kovy (Ru, Rh, Pd, Os, Ir, Pt)
Prvky zoskupené v skupinách
Ktoré prvky patria do konkrétnych skupín môžeš vidieť na obrázku nižšie. Prvky každej skupiny majú svoje charakteristické vlastnosti.
Chceš sa o skupinách dozvedieť viac?
Klikni!
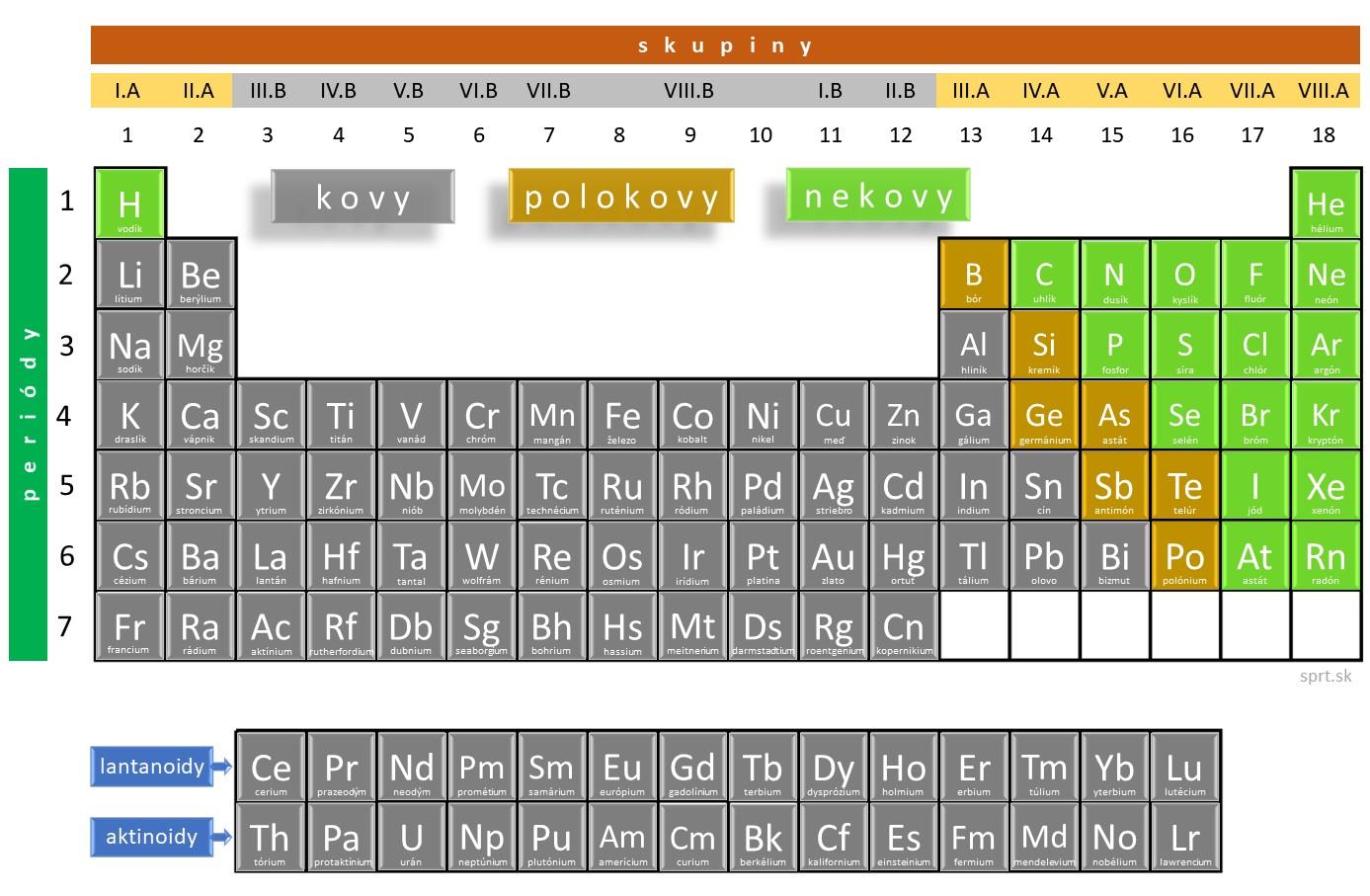
Rozdelenie podľa fyzikálnych vlastností
Podľa fyzikálnych vlastností môžeme prvky rozdeliť do 3 základných skupín na – nekovy, polokovy a kovy.
Kovy
Nachádzajú sa prevažne v ľavej časti periodickej tabuľky!
Tvoria väčšinu známych chemických prvkov, v periodickej tabuľke majú jasnú prevahu. V zemskej kôre sú z kovov najviac zastúpené hliník a železo.
Medzi atómami kovov je kovová väzba.
Zvyčajne majú nasledujúce vlastnosti:
– kovový lesk
– sú vodivé, to znamená že dobre vedú elektrický prúd a teplo (najlepším je striebro)
– sú kujné a ťažné, to znamená, že sa dajú tvarovať a naťahovať
– majú pevné skupenstvo (pri bežnej izbovej teplote), okrem ortuti, ktorá je tekutá.
Kovy majú nízku ionizačnú energiu (energia potrebná na uvoľnenie elektrónu – ľahko tvoria katióny).
Nekovy
Nachádzajú sa v pravej časti periodickej tabuľky!
Nevedú elektrický prúd, ani teplo.
Nie sú kujné, ťažné, nemajú kovový lesk. V organizmoch aj v zemskej kôre prevládajú nad kovmi.
Sú to prvky s veľkou elektrónovou afinitou (energia, ktorá sa uvoľní, keď atóm prijme elektrón – vznikajú anióny).
Štruktúru valenčných orbitálov majú podobnú najbližšiemu vyššiemu vzácnemu plynu (napríklad halogény).
Polokovy
V periodickej tabuľke tvoria hranicu medzi jej ľavou a pravou časťou.
Medzi polokovy patria prvky, ktoré majú vlastnosti na rozhraní medzi kovmi a nekovmi, teda niektoré vlastnosti kovov a niektoré nekovov (napr. bór, kremík). Väčšinou majú polovodičový charakter.
Čo sa z periodickej tabuľky dozvieš o prvku
V kompletnej periodickej tabuľke prvkov nájdeš pri každom prvku veľa značiek a čísel. Čo ktoré znamená môžeš vidieť na obrázku nižšie.
obrázok a text pripravujeme 🙂
Ako vznikajú názvy jednotlivých prvkov
obrázok a text pripravujeme 🙂
Zákonitosti v periodickej tabuľke prvkov
– veľkosť atómov v skupinách neprechodných prvkov s rastúcim protónovým číslom rastie
– hodnoty ionizačnej energie s rastúcim protónovým číslom v skupinách klesajú, v periódach rastú
– elektronegativita prvkov rastie zľava doprava a zdola nahor
– kovový charakter prvkov stúpa sprava doľava a zhora nadol.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
KUPKA. 2010. Periodická sústava prvkov. Praha. Kupka
obrázky a školské poznámky šprta