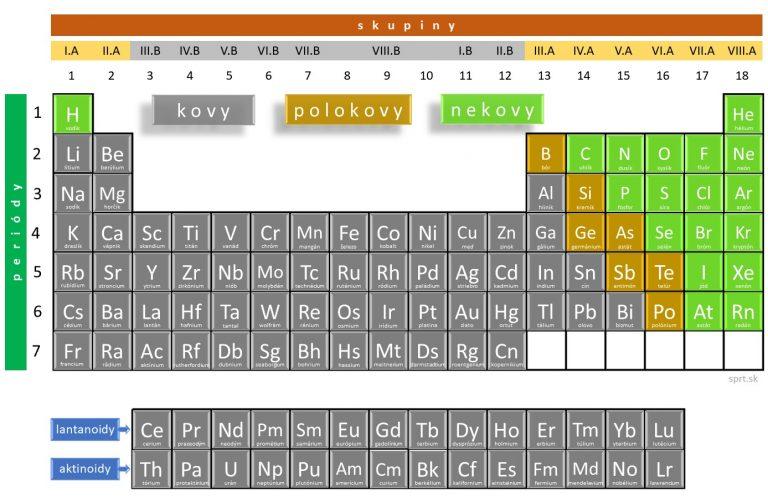
Kovy
Prvok je kovom, ak má počet elektrónov v najvyššej vrstve (valenčnej) menší, alebo rovný číslu skupiny. Tieto elektróny sú k jadru atómu viazané veľmi slabo.
Kovy majú nízku ionizačnú energiu, čo je energia potrebná na uvoľnenie elektrónu. Znamená to, že ľahko tvoria katióny.
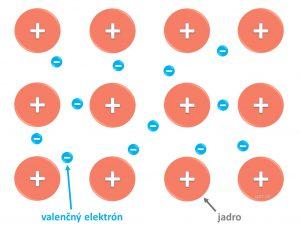
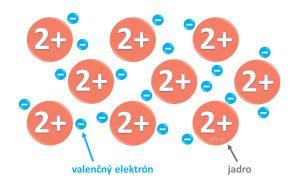
Kryštál kovu sa skladá z katiónov umiestnených v pravidelnej statickej kryštálovej mriežke, medzi ktorými sa voľne pohybujú valenčné elektróny (na obrázkoch vidíš dva druhy pravidelnej kryštalickej mriežky).
Práve valenčné elektróny sú rozhodujúce v tom, aké chemické vlastnosti má prvok.
Medzi atómami kovov je – kovová väzba.
Charakteristické vlastnosti kovov
Zvyčajne majú nasledujúce vlastnosti:
– kovový lesk
– sú vodivé, to znamená, že dobre vedú elektrický prúd a teplo (najlepším je striebro)
– sú kujné a ťažné, to znamená, že sa dajú tvarovať a naťahovať
– majú pevné skupenstvo (pri bežnej izbovej teplote), okrem ortuti, ktorá je tekutá.
Je jediným tekutým kovom naozaj len ortuť?
Ak za prirodzený stav považujeme izbovú teplotu 23 stupňov Celzia, tak ÁNO.
Ale!
V periodickej tabuľke sú ďalšie dva kovy, ktoré síce majú pevné skupenstvo, ale bod tavenia majú tak nízky, že v horúcom lete by sa rozpustili samé. Cézium (Cs) sa rozpúšťa už pri teplote 28,44 a gálium 29,76 stupňov Celzia.
Rozdelenie kovov podľa reaktivity
Rozdelenie kovov podľa hustoty
– ľahké kovy
majú menšiu hustotu ako 5 g/cm3 (5000 kg/m3).
Napr. hliník a titán. Tieto prvky síce majú menšiu hustotu, ale napriek tomu môžu byť pevné aj ľahké zároveň.
Titán má široké využitie práve vďaka svojej ľahkosti a pevnosti zároveň. Napr. v leteckom a vesmírnom priemysle, určite ste už počuli napr. aj o titánových sedlách pre cyklistov.
Hliník sa pre svoje vlastnosti tiež využíva v elektrotechnike, leteckom a automobilovom priemysle, potravinárstve ale aj stavebníctve.
Najtoxickejšie ťažké kovy sú: kadmium, ortuť, arzén a olovo.
Ortuť je zaujímavá aj tým, že ako jediný kovový prvok je tekutý pri izbovej teplote (23 stupňov Celzia). Nie je to tak dávno kedy sa využíval ako náplň do teplomerov.
Medzi ťažké kovy zaraďujeme aj: meď, chróm, nikel, mangán, zinok, striebro, kobalt, antimón a tálium.
Prečo sú toxické ťažké kovy pre živé organizmy nebezpečné?
Keď sa dostanú do organizmu, narušia bunky a organizmus prestáva správne fungovať.
Toxický vplyv arzénu, olova a ortuti poznali ľudia už v stredoveku. Využívali sa často ako otrava, ale aj v kozmetike.
Až od roku 1868 sa robia odborné štúdie o vplyve niektorých toxických ťažkých kovov. Ľudské telo ich nedokáže vylúčiť, v tele sa hromadia a vznikajú veľké zdravotné ťažkosti, až smrť.
Niektoré prvky považované za toxické ťažké kovy sú pre ľudské zdravie aj prospešné. Ale len vo veľmi malých dávkach. Ide napríklad o zinok, ktorý náš organizmus pre svoje správne fungovanie potrebuje.
Zliatiny
Doteraz sme hovorili o čistých kovoch. V priemysle sa však využívajú najmä ich zliatiny.
Zliatiny sú tuhé rovnorodé zmesi, vyrobené najčastejšie z kovov. Rozšírené sú preto, lebo po zmiešaní majú lepšie vlastnosti ako čisté prvky.
Najbežnejšie zliatiny
– bronz (meď + cín)
– mosadz (meď + zinok)
– spájka (olovo + cín)
– oceľ (železo + uhlík + ďalšie prvky)
– dural (hliník + horčík + ďalšie prvky)
Podrobnejšie o zliatinách
Zliatina medi
BRONZ
(meď + cín)
Bronzových sôch je dnes na námestiach miest umiestnených veľa. Určite niektorú poznáš zo svojho okolia aj ty. Najpopulárnejšou bronzovou sochou je napríklad v Bratislave určite „Čumil“.

Bronz je veľmi starý a tvrdší ako kameň. Svoj pôvod má na Blízkom východe v Mezopotámii, kde ho vyrobili v období asi 3500 pred n.l. Z dejepisu si možno pamätáš názov Doba bronzová. Ide o historické obdobie, kedy bol bronz objavený. Spomenuli sme, že to bolo v čase asi 3500 rokov pred n.l., bežnou a pomerne lacnou súčasťou života ľudí na celom svete sa stal bronz až v čase približne 1500 rokov pred n.l.
A prečo sa z neho robí toľko sôch?
Bronz má nižšiu teplotu tavenia ako meď, dá sa teda výborne odlievať do foriem. To umožňuje robiť lacno a rýchlo zložité tvary a presné odliatky. Oproti medi má zas napr. väčšiu tvrdosť.
Vieš čo je to „odlievanie na stratený model?“
Je to špeciálna a stará technika odlievania. Model sa vyrobí z ľahko tvarovateľného vosku, obloží sa hlinou a vypáli. Pri vypálení sa vosk vytaví a ostane presná hlinená forma na odlievanie bronzu. Používa sa hlavne na komplikované tvary, akými sú aj sochy.
MOSADZ
(meď + zinok)
Mosadz je zliatina medi (Cu) a 5 – 40% zinku (Zn), niekedy s malou prímesou olova alebo niklu. Základom mosadze je teda meď.
Výborne odoláva korózii, je veľmi dobre tvarovateľná a spracovateľná. Spracúva sa odlievaním, ťahaním, tlačením a obrábaním.
Množstvo zinku ovplyvňuje vlastnosti mosadze. Zvyšuje bod topenia, čo spôsobuje, že klesá hustota, elektrická aj tepelná vodivosť. Naopak, koeficient teplotnej rozťažnosti, pevnosť a tvrdosť stúpajú.
Má atraktívnu farbu. V závislosti od množstva medi je mosadz sfarbená od medenej červenej, cez bledší bronzový odtieň až po zlatú. Tá je veľmi podobná 14 karátovému zlatu a hovorí sa jej tiež šperková mosadz.
Mosadz zložená z medi, zinku a niklu sa volá alpaka. Nikel jej dodáva bielu farbu a tak úspešne nahradila striebro.
Využitie: hudobné nástroje a iné predmety vyrobené opracovaním plechov, ozdobné prvky v architektúre, lodné časti, chladiace jednotky, šperky, nábojnice do zbraní, výmenníky tepla, kúrenárske ventily, vodovodné kohútiky a potrubia, spony, pružiny a iné.

priemysel

šperky

úžitkové predmety

hudobné nástroje
Mosadz už od svojho začiatku slúžila ako úžitkový a výtvarný materiál. O mosadzi vedeli už starí Gréci a rímske dielne vyrábali z mosadze rôzne predmety už v 2. storočí n.l. Až 1000 rokov po zániku Rímskej ríše znovu obnovili tradíciu výroby úžitkových medených predmetov majstri z Flámska. Tí šírili svoje výrobky do celej Európy.
Vyrábali sa najmä svietniky, liturgické predmety do kostolov a chirurgické nástroje. Od stredoveku až do 18. storočia sa z mosadze vyrábali aj šperky pre chudobnejších.
V 17. storočí došlo k zavedeniu priemyselnej výroby zinku a z mosadze sa začali vyrábať kompasy, hodiny, astronomické nástroje a iné.
V 19. storočí sa mosadz výrazne rozšírila v staviteľstve o kovania okien, držadiel, zábradlí a pod. Predmetmi z alpaky sa pýšili meštianske domy, kde lacnejšia zliatina nahradila striebro na nerozoznanie.
Zliatina olova
SPÁJKA
(olovo + ďalší prvok)
Spájkovanie je spájanie kovových a nekovových častí roztavenou spájkou.
Tá sa využíva najmä v elektrotechnike na zhotovovanie spojov. Využívané sú aj pri výrobe dielcov do elektrických motorov, jadrových reaktorov, tepelných výmenníkov, ale aj v stavebníctve.
Najčastejšie používanou spájkou je asi olovo+cín. Ale bežne sa stretneme aj s medenou alebo mosadznou spájkou a spájkou na oceľ.
Spájka samotná sa vyrába ako navinutý drôt, alebo ako rovná spájkovacia tyčinka.
Pri spájkovaní dochádza k zahriatiu spájky na vysokú teplotu (okolo 700 stupňov celzia) a tým k jej roztaveniu. V tekutom stave sa nanáša na spájané materiály a vytvorí ich spojenie.




Zliatina železa
OCEĽ
(železo + uhlík + ďalšie prvky)
Oceľ je najviac využívaný kov na svete.
Je to zmes železa (Fe), uhlíka (C) a niekoľkých ďalších prvkov. Vždy je tam mangán (Mn) a kremík (Si). Tavením týchto prvkov vzniká zliatina, ktorá sa volá oceľ.
Čisté železo (Fe) je mäkký a dobre tvarovateľný kov, ktorý sa dá výborne zvárať. Tvrdosť a pevnosť získava až po pridaní uhlíka (C).
Oceľ môže obsahovať aj ďalšie prvky:
– síra, fosfor, dusík, vodík, kyslík, ktoré majú na jej kvalitu nepriaznivý vplyv,
– meď a mangán, ktoré jej kvalitu ovplyvňujú zasa pozitívne.
Niektoré tieto prvky sa do ocele dostávajú zo železnej rudy, z ktorej sa vyrába železo, iné z atmosféry, alebo počas výrobného procesu.
Špeciálnou prímesou ocele je nikel, ktorý jej vlastnosti ovplyvňuje pozitívne. Oceľ s touto prímesou, ktorú v prírode neobsahujú žiadne rudy, je výrazne kvalitnejšia, má „krajší zvuk“. Prítomnosť niklu je dôkazom jeho meteorického pôvodu. Kedysi sa mu hovorilo aj „železo z neba.“
Pri oceli sa môžeme stretnúť s názvom „legovanie ocele,“ alebo „legovaná oceľ.“ Znamená to, že oceľ (zmes železa a uhlíka) je obohatená o ďalší prvok, ktorý významným spôsobom mení jej vlastnosti. Takýmito prísadami je napríklad chróm, vanád alebo molybdén. Celkovo je týchto prvkov až 13.




Najväčšiu pevnosť má oceľ vtedy, ak je podiel uhlíka približne 1%.
Množstvo uhlíka v oceli môže byť rôzne. V priemysle hovoríme o oceli, ak je podiel uhlíka menší ako 2,14%.
Ak je uhlíka viac ako 2,14%, materiál už nadobúda iné vlastnosti, najmä krehkosť, a nazývame ho liatina.
Najväčším nepriateľom ocele je hrdza! Treba ju pred ňou chrániť. Tu prichádza na rad legovanie, o ktorom sme písali vyššie. Ešte čosi zaujímavé pridáme.
Legovanie nie je len zlepšovanie vlastností ocele. Je to celkovo názov pre metalurgický proces zlepšovania zliatin – všetkých. Napríklad aj v zlatníctve.
Zliatinové prvky (prvky, ktoré sa do zliatiny pridávajú) sa volajú legúry. Pridávajú sa počas výrobného procesu. Legované materiály môžeme rozdeliť do 3 základných skupín:
– nízko legované – obsah legúr (prísad) je do 5%
– stredne legované – obsah legúr je 5-10 %
– vysoko legované – obsah legúr je nad 10%.
Späť k oceli. Ktoré prvky patria medzi tých 13 „zázračných“, ktoré výrazne zlepšujú jej vlastnosti?
Sú to mangán (Mn), chróm (Cr), molybdén (Mo), nikel (Ni), kremík (Si), wolfrám (W), vanád (V), bór (B), hliník (Al), cér (Ce), kobalt (Co), meď (Cu), niób (Ni) a tantal (Ta).
Prečo?
Určite poznáte nerezovú oceľ. Nehrdzavie, krásne sa leskne, výborne sa brúsi, nevylamuje sa, je húževnatá a pevná. Výborné vlastnosti získala svojim zložením.
Obsahuje: vysoký podiel uhlíka (1,34%), 14 % chrómu, 2% molybdénu, 3% vanádu, 0,58% nióbu, 0,5% kobaltu, 0,4 % volfrámu, 0,5% mangánu, 0,5% kremíka a troška fosforu a síry.
Aj nerezových ocelí je viac, záleží od presnej receptúry. Označené sú značkami – napr. S35VN, D2 a pod.
Aké vlastnosti jednotlivé prvky oceli dodávajú? Tak napr.
uhlík – výrazne zvyšuje tvrdosť,
chróm – výrazne zvyšuje odolnosť voči korózii,
nikel – zaručuje dobrú leštiteľnosť,
kobalt a niób – prispievajú k ďalšiemu zvýšeniu tvrdosti,
wolfrám – zaručuje odolnosť voči vysokým teplotám.
A kto na ochranu ocele pred hrdzou prišiel? V roku 1913 chemik Harry Breakly pracoval v Anglicku na pokusoch so zliatinami. Ako to už vo vede býva, na recept pridania chrómu do ocele prišiel celkom náhodou.
Zliatina hliníka
DURAL
(hliník + horčík + ďalšie kovy)
Dural je zliatina hliníka (Al), s menším podielom medi (Cu) a horčíka (Mg).
Dural je veľmi ľahký, má nízku hmotnosť. Využíva sa preto hlavne v leteckom a automobilovom priemysle napr. na hliníkové disky kolies osobných áut, plášte lietadiel a pod.
Biogénne kovové prvky
Biogénne prvky sú chemické prvky, ktoré sa vyznačujú tým, že sa nachádzajú v živých organizmoch. Sú veľmi dôležité pre ich zdravie, a teda aj pre zdravie človeka.
Tu sú niektoré z nich:
Železo (Fe-ferrum)
železo (Fe)
medzi biogénnymi prvkami je asi najdôležitejší, lebo je potrebný pre prenos kyslíka v krvi.
Do tela sa dostáva len potravou.
Zdroje železa: orechy, strukoviny, mäso, vaječný žĺtok, mak, strukoviny, listová zelenina, obilniny, voda a iné.

V tele dospelého človeka je 3,0 až 5,0 g Fe!
Množstvo železa je väčšie v tele muža ako ženy!
Muž: 4,0 – 4,5 g.
Žena: 2,6 – 3,0 g.

Naše telo dokáže ľahšie vstrebať železo prijaté z mäsitej stravy – tzv. hemové železo.
Zo stravy prijme asi 20-25% Fe.
Vápnik (Ca-calcium)
vápnik (Ca)
je dôležitý pre zdravý vývoj našich kostí a zubov ale aj pre správne fungovanie buniek, svalov, správny prenos nervových impulzov, alebo pre správne zrážanie krvi. Riadi tiež činnosť hormónov a reguluje srdcovú aktivitu.
Zdroje vápnika: mak, strukoviny, orechy, ryby, brokolica, pór, kapusta, kel, obilniny, mliečne výrobky, slnečnicové semienka, sezam, pomaranče, droždie, vajcia, voda a iné.

Vápnik tvorí asi 1,5% hmotnosti ľudského tela, z čoho 99% je uložených v kostiach a zuboch.
Z normálne pestrej stravy dokáže ľudské telo vstrebať asi 25-40% prijatého množstva.

Najviac vápnika sa do ľudského tela vstrebe, ak prijímame zároveň vitamín D alebo kyselinu listovú.
Horčík (Mg-magnesium)
horčík (Mg)
je dôležitý pre správne fungovanie svalov, nervov a krvného obehu.
Zdroje horčíka: listová zelenina, mak, strukoviny, orechy, banány, voda…
Čím má rastlina sýtejšiu zelenú farbu a čím je horkejšia, tým viac horčíka obsahuje.

Ideálne množstvo horčíka u dospelého je 30 g. Potravou a vodou ho denne prijímame asi 300 mg.
Kozie mlieko obsahuje viac horečnatých iónov, ako mlieko materské.

Biele škvrny na nechtoch signalizujú nedostatok horčíka v tele.
Fajčenie výrazne zabraňuje vstrebávaniu horčíka do tela.
Zdroje:
Theodore Gray, 2012. Prvky – obrazový průvodce všemi známými atomy ve vesmíru. SLOVART
Radomír Pleiner, 1962. Staré evropské kovářství. Československá akademie věd.
Karol Vasilko, 2012. História a vývoj techniky. Technická univerzita v Košiciach.
Výskumný ústav zváračský – Priemyselný inštitút SR. Spájky a tavivá na spájkovanie – katalógový list. www.vuz.sk
zo školských poznámok šprta (z chémie a z biológie)