Halogény - skupina
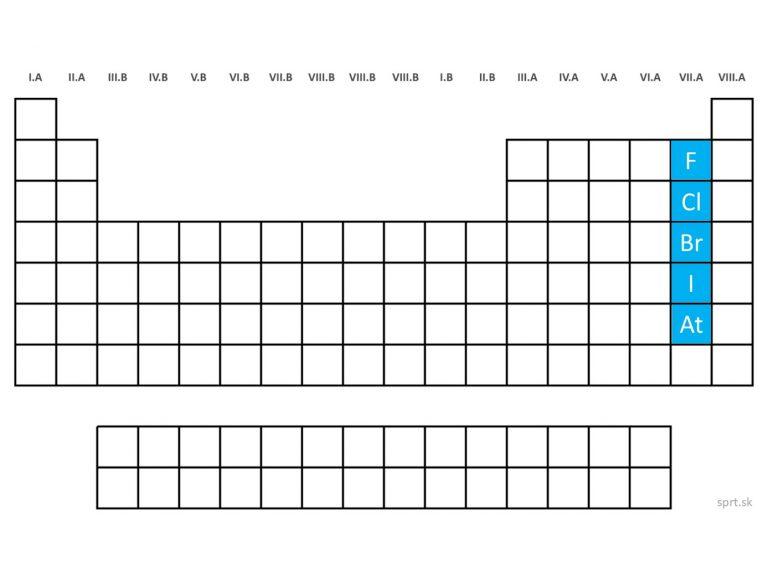
Do skupiny halogénov, alebo prvkov VII.A skupiny zaraďujeme prvky:
fluór, chlór, bróm, jód a astát.
So stúpajúcim protónovým číslom klesá ich reaktivita.
Valenčné orbitály atómov s menším protónovým číslom sú bližšie k jadru, čo spôsobuje, že ich elektróny sú viazané pevnejšie, ako pri atómoch s väčším protónovým číslom.
Halogény majú na valenčnej vrstve 7 elektrónov, zaraďujú sa medzi p-prvky.
Sú veľmi elektronegatívne, ľahko prijímajú elektróny a tvoria tak anióny. S kovmi reagujú za vzniku solí.
Prvky v tejto skupine reagujú rovnakým spôsobom a takisto tvoria podobné zlúčeniny. Reaktívnejšie halogény vytesňujú zo zlúčenín tie menej reaktívne.
Halogény sú jedovaté, majú charakteristický zápach. Taktiež sú veľmi reaktívne a majú vysokú elektronegativitu.
V prírode sa nevyskytujú v nezlúčenej forme.
Halogény - popis jednotlivých prvkov
fluór - F (fluorum)
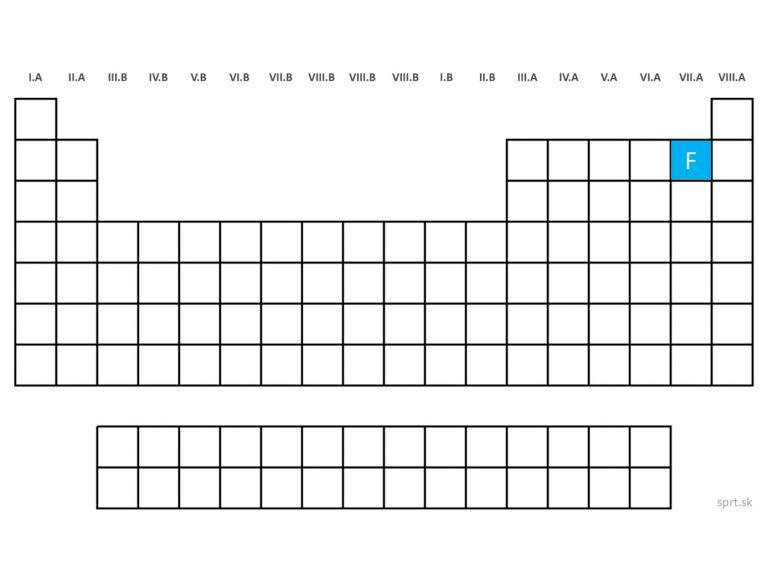
Fluór je zelenožltý plyn, agresívny a toxický. Je najreaktívnejším nekovom, je 1-väzbový. Veľmi ľahko tvorí zlúčeniny, napríklad fluorid sodný nájdeme aj v zubných pastách. V prírode je menej rozšírený, nachádza sa napr. vo fluorite (kazivec), kryolite, alebo apatite. Pripravuje sa elektrolýzou KF.
Využívame ho v jadrovej energetike, ako oxidačné činidlo, alebo na výrobu organických látok ako teflón, freón, či liečivá. Patrí medzi biogénne prvky, je dôležitý pre kosti a zuby.
chlór - Cl (chlorum)
Chlór je žltý plyn, rovnako ako aj fluór je agresívny a toxický. Spomedzi všetkých halogénov je v prírode najzastúpenejší. Vo vode je málo rozpustný, môže byť 1 až 5-väzbový.
Zaraďuje sa medzi biogénne prvky, pre človeka je dôležitý napríklad pri trávení (kyselina HCl v žalúdku). V prírode sa vyskytuje napr. vo forme halitu (NaCl), sylvínu (KCl), karnalitu. Nájdeme ho aj v morskej vode.
Získava sa elektrolýzou roztoku NaCl.
Používame ho na výrobu dezinfekčných, čistiacich, alebo bieliacich prostriedkov, pri výrobe PVC, alebo organických bojových látok (yperit, fosgén).
bróm - Br (bromum)
Bróm je ako jediný z nekovov pri izbovej teplote kvapalný, sfarbený do červenohneda. Vo vode je málo rozpustný. Rovnako ako chlór, aj tento prvok je 1 až 5-väzbový.
Nachádza sa v morskej vode, kde sprevádza chloridy.
Získava sa z morskej vody reakciou bromidu draselného s molekulou chlóru, pri čom vzniká chlorid draselný a bróm. Inou možnosťou je zahrievanie bromidu alkalických kovov s oxidom manganičitým v prostredí kyseliny sírovej.
Jeho zlúčeniny využívame vo fotografii, pri výrobe hasiacich látok a liečiv.
Je toxický, leptá sliznice.
jód - I (iodum)
Jód je 1 až 7-väzbový, pri normálnych podmienkach je pevnou sivastou kryštalickou látkou s kovovým vzhľadom, vo vode málo rozpustný. Pri sublimácii sú jeho pary fialové.
Zaraďujeme ho medzi biogénne prvky, u človeka je dôležitý najmä pre funkciu štítnej žľazy. Nachádza sa v morskej vode vo forme jodidov a zároveň je viazaný aj v organických zlúčeninách morských rastlín a živočíchov. Vyrába sa oxidáciou jodidov.
Používa sa hlavne v lekárstve (kontrastná látka pri rontgene), výrobe liečiv a jódovej tinktúry.
astát - At (astatium)
Astát je z halogénov najťažší, nestály, veľmi vzácny a rádioaktívny. V prírode je ho minimálne množstvo, je produktom rádioaktívneho rozpadu uránu (U), aktínia (Ac) a thória (Th). Z podoby pevnej látky dokáže sublimovať.
Ďalšie fakty o halogénoch
Všetky spomenuté prvky sú rozpustné v nepolárnych rozpúšťadlách a do elektrónovej konfigurácie vzácneho plynu im chýba jeden elektrón.
Sú solitvorné, vyskytujú sa vo forme dvojatómových molekúl.
Fluór spolu s jódom sú izotopicky čistými látkami.
Najsilnejším oxidovadlom je fluór, všetky halogény však majú túto schopnosť.
Zlučujú sa priamo s množstvom nekovov, pri reakcii s vodou vznikajú halogénvodíky, pri reakcii s kovmi halogenidy.
Za normálnych podmienok sa halogény vyskytujú ako dvojatómové molekuly.
Tvoria kovalentné, kovalentné polárne a iónové väzby.
Oxidačná schopnosť halogénov klesá rovnako ako elektronegativita a reaktivita, v periodickej tabuľke zhora nadol.
Oxidy halogénov
Oxidy halogénov sú nestále, okrem oxidu jodistého sa rozkladajú. Sila kyslíkatých kyselín rastie so stúpajúcim oxidačným číslom halogénu alebo s jeho rastúcou elektronegativitou.
Pozri aj informácie o celej Periodickej tabuľke prvkov (PTP).
Zdroje:
BELANOVÁ a spol. 2013. Školská encyklopédia biológie, chémie a fyziky. Bratislava. PRÍRODA
KUPKA. 2010. Periodická sústava prvkov. Praha. kupka
DVOŘÁČKOVÁ. 2013. Chemie pro každého. Olomouc. Rubico