Krátky slovník - vysvetlenie pojmov
Ionizačná energia – energia potrebná na odtrhnutie elektrónu od atómu, vzniká katión
Elektrónová afinita – energia, ktorá sa uvoľní pri vzniku aniónu, teda prijatí elektrónu
Väzbová energia (disociačná) – energia potrebná k rozštiepeniu chemickej väzby, je rovnaká ako energia, ktorá sa uvoľní pri vzniku väzby
Elektronegativita – schopnosť atómu priťahovať k sebe elektróny
Chemická väzba – sila, ktorou sú navzájom spojené atómy v molekule
Dĺžka väzby – vzdialenosť atómových jadier atómov v zlúčenine
Väzbový uhol – uhol, ktorý zvierajú dve väzby vychádzajúce z atómu
Väzbovosť – počet kovalentných väzieb vychádzajúcich z atómu prvku v zlúčenine
Molekulový orbitál – priestor v okolí atómových jadier, v ktorom sa s najväčšou pravdepodobnosťou vyskytuje väzbový elektrónový pár
Chemická väzba
Chemická väzba je sila, ktorá k sebe púta atómy prvkov v zlúčenine vďaka valenčným elektrónom.
Vo všeobecnosti platí, že chemické väzby zanikajú a vznikajú počas reakcie.
Pri tvorbe väzby sa uvoľňuje energia, ktorú nazývame väzbovou energiou. Na to, aby sme chemickú väzbu rozštiepili, potrebujeme dodať tzv. disociačnú energiu. Tieto dve energie majú rovnakú veľkosť. Odlišujú sa v znamienkach a obe udávame v kJ/mol. Čím je väzbová energia väčšia, tým pevnejšia je väzba v zlúčenine.
Aby mohla chemická väzba vzniknúť, musia sa k sebe dostatočne priblížiť atómy s potrebným množstvom energie a správnou priestorovou orientáciou. Dĺžka väzby je vzdialenosť jadier atómov viazaných v molekule.
Rozlišujeme niekoľko typov chemických väzieb.
Kovalentná väzba
Pri tomto type chemickej väzby majú oba atómy väzbové elektrónové páry spoločné. Podľa Pauliho princípu majú tieto elektróny opačné spiny, patria súčasne obidvom atómom. Každý z atómov spojený týmto typom väzby dosahuje stabilnú elektrónovú konfiguráciu najbližšieho vzácneho plynu.
Počet kovalentných väzieb, ktoré vychádzajú z atómu prvku v zlúčenine alebo počet elektrónových párov, ktoré tvorí atóm s inými atómami, sa nazýva väzbovosť atómu, resp. prvku. Na jej určenie sa pri prvkoch 2. a 3. periódy používa oktetové pravidlo.
Atómy tvoria toľko väzieb, aby dosiahli vytvorením spoločných elektrónových párov stabilnú konfiguráciu vzácneho plynu. Elektróny vo väzbovom páre sa započítavajú do valenčnej vrstvy oboch atómov, medzi ktorými sa väzba vytvorila.
Napríklad kyslík má 6 valenčných elektrónov. Do konfigurácie vzácneho plynu mu teda chýbajú dva elektróny. Tie môže získať vytvorením dvoch jednoduchých, alebo jednej dvojitej väzby.
Pri priblížení dvoch atómov dochádza k prekrytiu ich valenčných orbitálov. Vzniká tak energeticky výhodnejší molekulový orbitál. V ňom sa elektróny vyskytujú rovnako ako v atómových orbitáloch. Každý tento orbitál je podobne ako atómové orbitály charakterizovaný určitým priestorovým rozložením a tvarom. Podľa tvaru rozlišujeme orbitály typu σ (sigma) a п (pí).
Obsadením molekulového orbitálu σ vzniká väzba σ. Jej elektrónová hustota je najväčšia na spojnici jadier atómov. Molekulový orbitál σ môže vzniknúť viacerými spôsobmi:
- prekrytím orbitálov sa s, s a p, alebo s a d
- prekrytím odbitálov p a p, alebo p a d
- prekrytím orbitálov d a d
Obsadením molekulového orbitálu п vzniká väzba п. Najväčšiu elektrónovú hustotu má mimo spojnice jadier, ale v rovine, ktorá ňou prechádza. Táto väzba vzniká až po vzniku väzby sigma a podieľa sa na vzniku násobných väzieb. Oproti väzbe σ je slabšia, preto sú zlúčeniny s násobnou väzbou reaktívnejšie oproti zlúčeninám s jednoduchou väzbou. Molekulový orbitál п môže vzniknúť:
- prekrytím dvoch orbitálov p
- prekrytím orbitálu p a d
- prekrytím dvoch orbitálov d
Násobnosť kovalentnej väzby
Jednoduchá väzba
Jednoduchá väzba je medzi atómami, ktoré majú spoločný jeden elektrónový pár. Charakterizujeme ju tiež ako väzby σ. Je slabšia ako násobné väzby.
Dvojitá väzba
Dvojitá väzba je medzi atómami, ktoré majú spoločné dva elektrónové páry. Tvorí ju jedna väzba σ a jedna väzba п. Oproti jednoduchej väzbe je kratšia, no pevnejšia.
Trojitá väzba
Trojitá väzba je medzi atómami, ktoré majú spoločné tri elektrónové páry. Tvorí ju jedna väzba σ a dve väzby п. Je najpevnejšia aj najkratšia.
Polarita kovalentnej väzby
Každý atóm dokáže priťahovať väzbové elektróny. Táto schopnosť sa nazýva elektronegativita a označuje sa písmenom X. Atóm, ktorý má elektronegativitu vyššiu, k sebe elektrónový pár vo väzbe priťahuje silnejšie ako druhý atóm – s nižšou elektronegativitou. Podľa rozdielu elektronegativít jednotlivých atómov vo väzbe určujeme jej polaritu. Následne delíme kovalentnú väzbu na polárnu a nepolárnu.
Nepolárna kovalentná väzba
Nepolárna kovalentná väzba vzniká medzi rovnakými atómami, alebo atómami, ktorých rozdiel elektronegativít je menší, ako 0,4. Elektrónová hustota medzi atómami je rozdelená rovnomerne, obidve jadrá priťahujú väzbové elektróny rovnakou, alebo veľmi podobnou silou.
Látky s touto väzbou sú nerozpustné vo vode, no dajú sa rozpustiť v nepolárnych rozpúšťadlách. Nevedú elektrický prúd.
Polárna kovalentná väzba
Polárna kovalentná väzba vzniká medzi dvoma rôznymi atómami, ktorých rozdiel elektronegativít je väčší ako 0,4, ale menší ako 1,7.
Na atóme s vyššou elektronegativitou prevláda záporný náboj, pretože v jeho okolí je elektrónová hustota vyššia, ako v okolí druhého atómu. Na tom je naopak kladný náboj. Molekula má teda kladný aj záporný pól – tvorí tzv. dipól. Označujeme ho horným indexom δ + (kladný pól) a δ – (záporný pól).
Nie vždy sa do väzby zapájajú všetky valenčné elektróny atómu. Tie, ktoré sa nezapoja, nazývame voľné elektrónové páry. Predstavujú zvýšenú elektrónovú hustotu, odpudzujú od seba väzbové elektróny a tým zmenšujú väzbový uhol. Voľné elektrónové páry teda určujú konečný tvar molekuly.
Látky s touto väzbou sú vo vode rozpustné, v nepolárnych rozpúšťadlách sa nerozpustia. V roztoku alebo tavenine vedú elektrický prúd.
Iónová väzba
Dá sa povedať, že iónová väzba je extrém kovalentnej väzby. Rozdiel elektronegativít atómov prvkov je v tomto prípade väčší ako 1,7. Väzbový elektrónový pár tak takmer úplne patrí do elektrónového obalu atómu s väčšou elektronegativitou.
Elektropozitívnejší atóm odovzdáva druhému atómu elektrón, z čoho vznikne kladne nabitý ión – katión a záporne nabitý ión – anión. Ióny v týchto zlúčeninách sa navzájom priťahujú elektrostatickými silami.
Aj pri tomto type chemickej väzby platí oktetové pravidlo. Atómy nadobudnú stabilitu, keď majú na valenčnej vrstve osem elektrónov. Katióny vznikajú, keď atómy strácajú elektróny, anióny vznikajú, keď atómy elektróny prijímajú.
Zjednodušene povedané, pri iónovej väzbe si atómy navzájom vymieňajú jeden, alebo viac elektrónov, aby mali na valenčnej vrstve osem elektrónov.
Koordinačne-kovalentná väzba
Tento druh väzby sa nazýva taktiež donoro-akceptorovou väzbou. Jeden atóm – donor – poskytne obidva elektróny, zatiaľ čo druhý atóm – akceptor – poskytne voľný orbitál a tieto dva elektróny prijme. Takáto väzba sa vlastnosťami nelíši od kovalentnej.
Prvok poskytujúci voľný orbitál je kov a vystupuje ako centrálny atóm – atóm, na ktorý sa upínajú ligandy. Ligandy sú všetky prvky alebo molekuly, ktoré sú súčasťou komplexnej zlúčeniny a poskytujú centrálnemu atómu voľný elektrónový pár.
Kovová väzba
Vzniká medzi atómami kovových prvkov v tuhom skupenstve. Jednotlivé atómy sú blízko pri sebe, dochádza tak k prekryvu ich orbitálov a delokalizácii voľných valenčných elektrónov. Tie sa vďaka tejto skutočnosti môžu voľne pohybovať po celej štruktúre, okolo všetkých katiónov kovu rozmiestnených v pravidelnej mriežke. Kovovú väzbu spôsobuje elektrostatická príťažlivosť katiónov kovov a valenčných elektrónov, ktoré sa voľne pohybujú.
Látky s touto väzbou vedú elektrický prúd (pohyb delokalizovaných elektrónov usmerníme jedným smerom) a teplo. Sú kujné a ťažné.
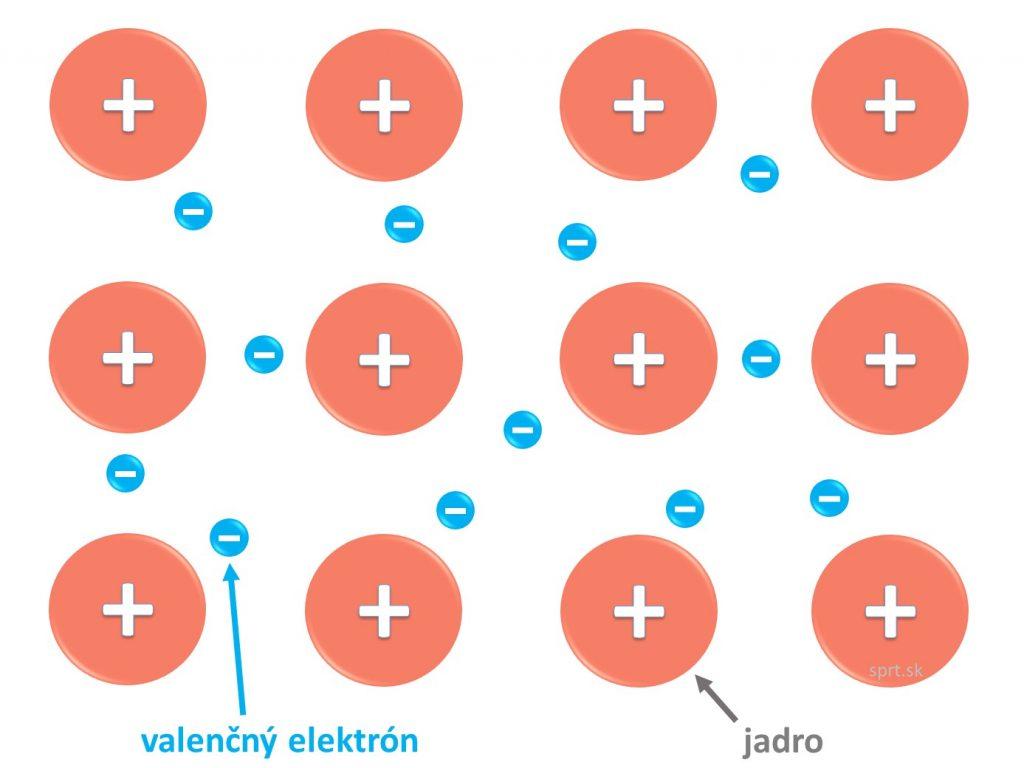
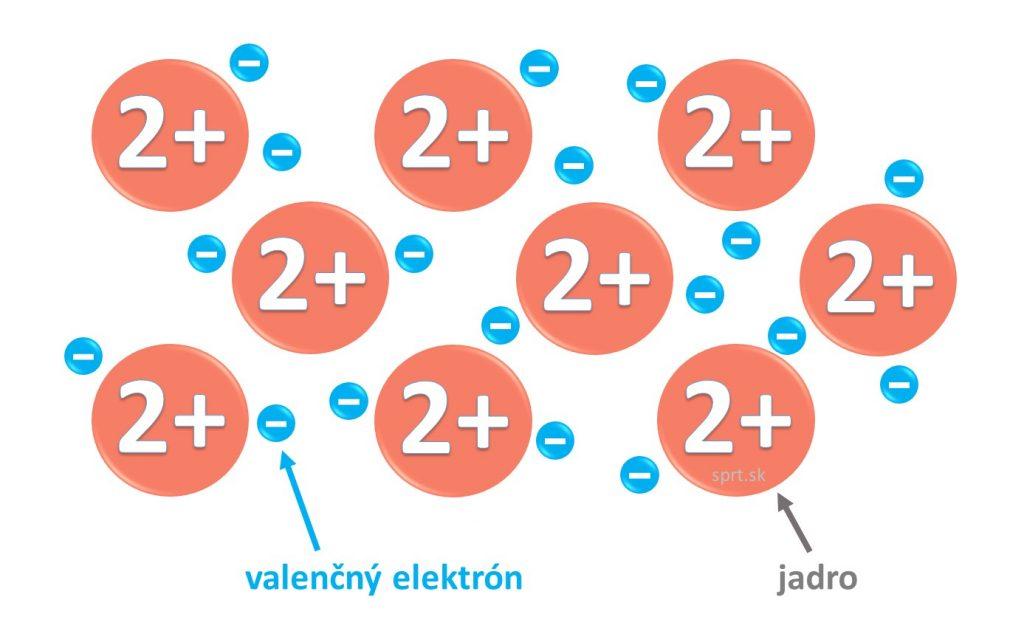
Látky s touto väzbou vedú elektrický prúd (pohyb delokalizovaných elektrónov usmerníme jedným smerom) a teplo. Sú kujné a ťažné.
Slabé väzbové interakcie
Existujú aj slabšie väzbové sily, ktoré však tiež ovplyvňujú vlastnosti látok. Patria sem:
Van der Waalsove sily
Van der Waalsove sily vznikajú vzájomným pôsobením molekulových dipólov (kladne a záporne nabitých častí molekuly). Prejavujú sa priťahovaním opačných pólov molekúl, alebo nábojov iónov.
Vodíková väzba
Vodíková väzba, nazývaná tiež vodíkový mostík, sa nachádza v zlúčeninách vodíka s prvkom, ktorý má vysokú elektronegativitu a neväzbový elektrónový pár (F, O, N). Atóm vodíka jednej molekuly tvorí slabú väzbu s voľným elektrónovým párom druhej molekuly.
Prítomnosť vodíkovej väzby v látke spôsobuje vyššiu teplotu topenia aj varu, keďže najprv sa energia spotrebúva na rozrušenie tejto väzby a až následne na rozrušenie väzby danej látky. Príkladom je voda.
Atómy niektorých prvkov sa môžu spájať rôznymi spôsobmi. Vytvárajú tak rôzne štruktúry nazývané alotropické modifikácie. Najznámejším príkladom je uhlík. Ten tvorí dva prirodzené alotropy: diamant a grafit. V diamante sú atómy pospájané v štvorstenovej mriežke, grafit má atómy usporiadané v šesťuholníkových vrstvách.
Alotropia sa týka iba rozličných foriem rovnakého prvku, zlúčeniny tieto modifikácie netvoria.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
BELANOVÁ a spol. 2013. Školská encyklopédia biológie, chémie a fyziky. Bratislava. PRÍRODA
GAJDOŠ a spol. 2011. VEDA. Bratislava. Ikar
DVOŘÁČKOVÁ. 2013. Chemie pro každého. Olomouc. Rubico
zo školských poznámok šprta