Chemická rovnica
Chemická rovnica je zápis, ktorým popisujeme chemickú reakciu.
Vyjadruje počiatočný a konečný stav reakčnej sústavy, teda reaktanty a produkty.
Prvky zapisujeme vždy značkami, zlúčeniny vzorcami.
Na ľavej strane uvádzame reaktanty, na pravej produkty. Pri vratných reakciách je toto pravidlo porušené.
Obe strany rovnice sú navzájom spojené šípkou smerujúcou od reaktantov k produktom.
Počet atómov každého prvku musí byť na obidvoch stranách rovnice zhodný!
Ak nie je, je nutné rovnicu vyrovnať – určiť počet jednotlivých typov molekúl a iónov zúčastňujúcich sa reakcie a zapísať príslušné číslice pred značky a vzorce.
Tieto čísla sa nazývajú stechiometrické koeficienty. Ich pomery vyjadrujú látkové množstvá zložiek a pomery počtov molekúl reaktantov a produktov.
Zápis chemickej rovnice
Príklad č.1
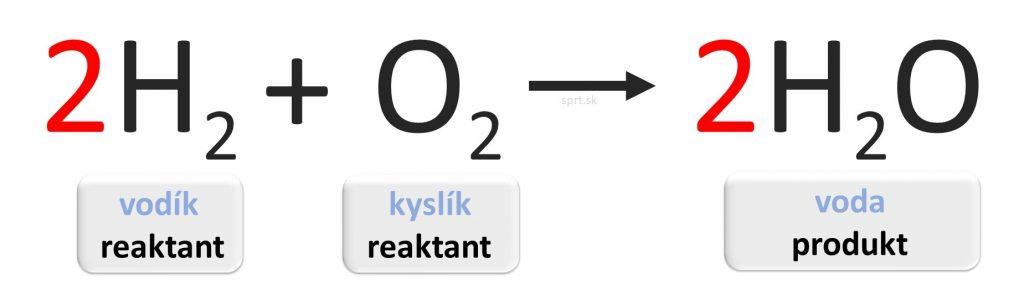
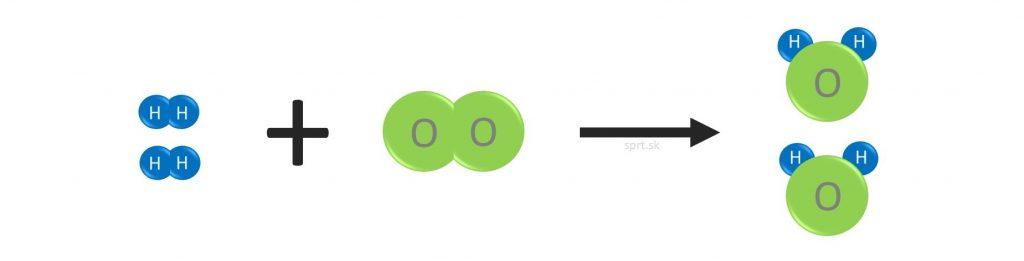
Príklad č.2
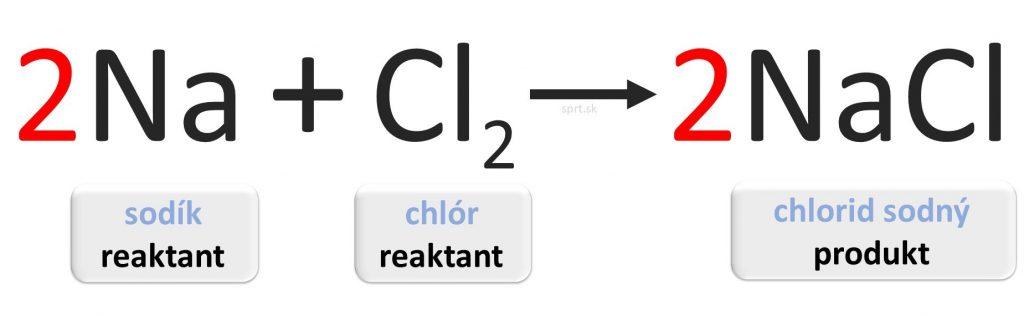
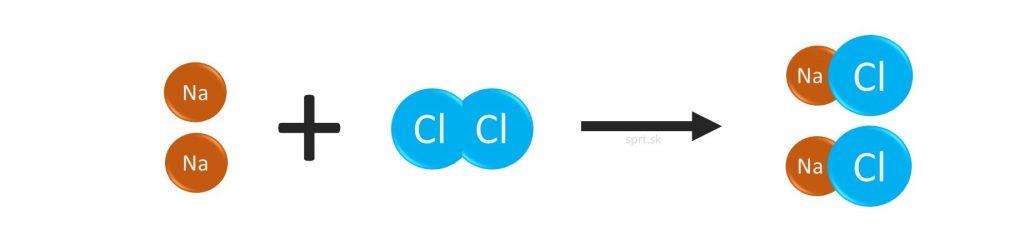
Príklad č.3
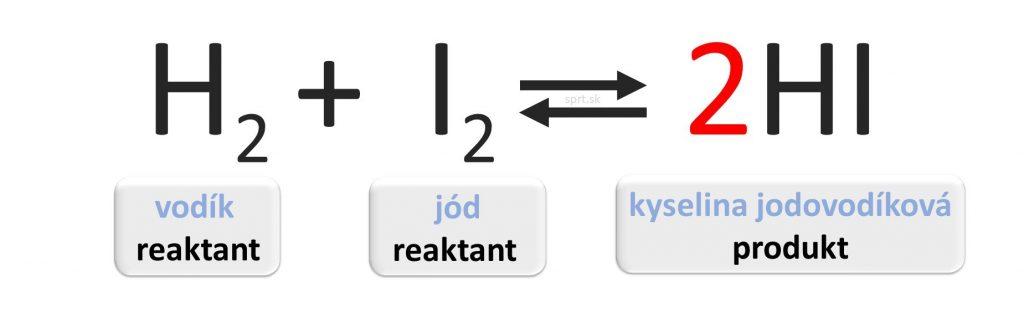
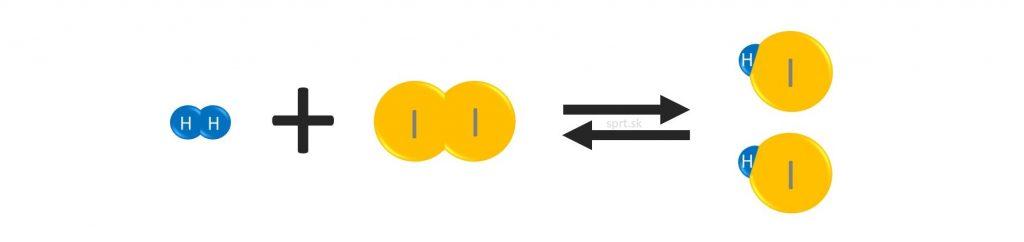
Dvoma šípkami, ktoré majú opačný smer sa v chemickej rovnici označuje vratná reakcia.
Znamená to, že zároveň s priamou reakciou prebieha aj spätná reakcia.
Pri priamej reakcii vzniká z reaktantov produkt, pri spätnej reakcii sa z produktu opäť stávajú východiskové látky.
Zápis skupenstva v chemickej rovnici
Často v rovniciach uvádzame aj skupenstvo jednotlivých látok. Zapisujeme ho formou symbolov v zátvorke za značkou, alebo vzorcom:
( g ) = gas = plynné skupenstvo
( l ) = liquidus = kvapalné skupenstvo
( s ) = solidus = pevné skupenstvo
( aq ) = aquaeus = vodný roztok
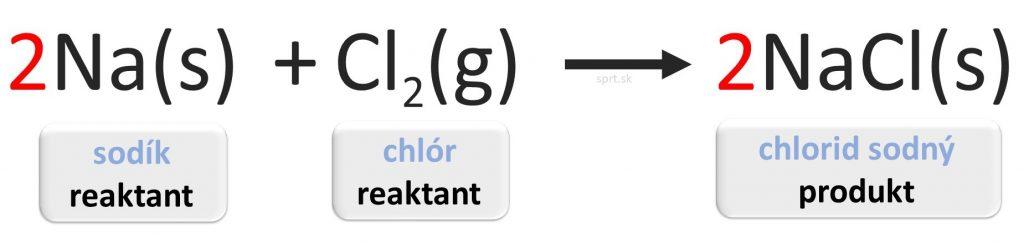
Tento zápis čítaj takto:
pevný sodík reaguje s plynným chlórom za vzniku pevného chloridu sodného
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
z poznámok šprta