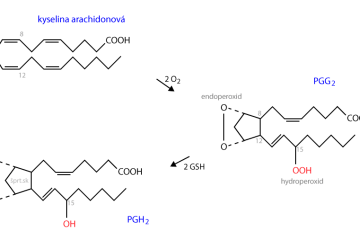
Elektrónová konfigurácia
Elektrónová konfigurácia nám ukazuje (popisuje) obsadenie orbitálov konkrétneho atómu elektrónmi.
Vysvetlime si to podrobne:
Obal každého atómu je tvorený elektrónmi.
Vieme vypočítať hodnotu pravdepodobnosti, s akou sa elektrón vyskytuje na danom mieste v obale atómu. Tá sa nazýva elektrónová hustota.
Oblasti, ktoré ju majú najvyššiu (najhustejší výskyt elektrónov) sa nazývajú orbitály. Orbitály sú teda oblasti obalu atómu, kde je výskyt elektrónov najhustejší.
Orbitály sú charakterizované troma kvantovými číslami. Ich kombináciami vieme popísať ľubovoľný orbitál v elektrónovom obale.
Hlavné kvantové číslo

Hlavné kvantové číslo sa označuje značkou „n„. Udáva energiu elektrónu a má hodnoty od 1 do nekonečna.
Elektróny, ktoré majú rovnaké hlavné kvantové číslo, sa nachádzajú na tej istej vrstve.
Orbitály atómu

Vedľajšie kvantové číslo so značkou „l “ určuje tvar a energiu orbitálu.
Nadobúda hodnoty od 0 do (n-1). Hodnoty sa zapisujú písmenom, ktoré prislúcha k danému číslu a zapisujú sa za hlavné kvantové číslo.
Označenie orbitálov
Rozlišujeme orbitály s (l=0), p (l=1), d (l=2) a f (l=3).
Orbitál s má tvar gule,
orbitál p má 3 možné priestorové orientácie,
orbitál d má 5 priestorových orientácií a
orbitál f má 7 priestorových orientácií.
V každej priestorovej orientácií orbitálu sa vyskytujú maximálne dva elektróny.
To znamená, že:
v orbitále typu s sú max. 2 elektróny,
v orbitále p max. 6 elektrónov,
v orbitále d max. 10 elektrónov a
v orbitále f maximálne 14 elektrónov.
Magnetické a spinové kvantové číslo
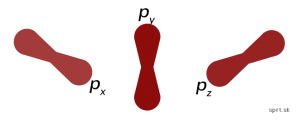
Magnetické kvantové číslo – „m „– určuje orientáciu orbitálu v priestore (na obrázku vidíš príklad p-orbitálu).
Hodnoty môže mať od (-l) po (+l), vrátane nuly.
Spinové kvantové číslo – „s„.
Neexistujú 2 elektróny, ktoré by mali všetky kvantové čísla rovnaké. Na to, aby sme vedeli odlíšiť elektróny, ktoré sa nachádzajú v rovnakom orbitále aj jeho priestorovej orientácii používame štvrté kvantové číslo. To určuje smer rotácie elektrónu a má hodnoty +1/2, alebo -1/2. Necharakterizuje orbitál, ale samotný elektrón. Tieto hodnoty sa skrátene nazývajú spin elektrónu.
Pravidlá pre zapĺňanie orbitálov
Pauliho princíp – v atóme nemôžu existovať elektróny, ktoré majú zhodné všetky štyri kvantové čísla. Vždy sa musia odlišovať aspoň spinovým. V každom orbitále môžu byť preto maximálne dva elektróny.
Hundovo pravidlo – orbitály sa najprv obsadzujú elektrónmi s rovnakým spinom, až potom sa dopĺňajú ďalším elektrónom so spinom opačným.

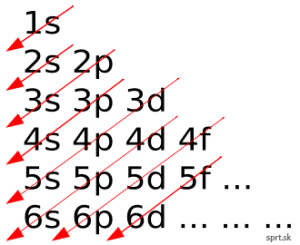
Výstavbový princíp – orbitály s nižšou energiou sa zapĺňajú elektrónmi skôr, ako orbitály s vyššou energiou.
Orbitály sa teda obsadzujú v poradí:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p atď.
Valenčné elektróny
Elektróny, ktoré sa nachádzajú v najvyššej vrstve, nazývame valenčné elektróny.
Určujú chemické vlastnosti atómu prvku.
Napr. dusík má 7 elektrónov. Jeho elektrónová konfigurácia je 1s2 2s2 2p3.
Valenčná vrstva je v tomto prípade tá, kde orbitály začínajú číslom dva, to znamená 2s2 2p3. Z toho vyplýva, že atóm dusíka má päť valenčných elektrónov.
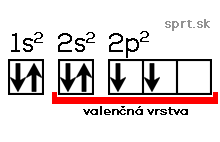
Čo znamená plná valenčná vrstva? Stabilitu prvku, jeho nereaktívnosť.
Vieš, ktoré prvky sa tým vyznačujú? Otvor si tento článok.
Na značenie elektrónovej konfigurácie používame niekoľko spôsobov. Môžeme si napísať hlavné kvantové číslo (1, 2, …) a za neho doplniť tvar orbitálu (s, p, d, f) podľa vedľajšieho čísla. Nad to následne napíšeme počet elektrónov, ktoré sa v danom orbitále nachádzajú.
Príklad 1:
Chceme zapísať elektrónovú konfiguráciu vodíka (H).
Jeho hlavné kvantové číslo je 1 a podľa periodickej tabuľky vieme, že má iba 1 elektrón.
Jeho elektrónová konfigurácia bude teda vyzerať takto: 1s1, kde:
„1“ značí elektrónovú vrstvu,
„s“ tvar orbitálu a
„1“ v hornom indexe určuje počet elektrónov.
Príklad 2:
Zo zložitejších prvkov môžeme skúsiť vyjadriť konfiguráciu selénu (Se).
Podľa postavenia v tabuľke vieme, že:
– patrí medzi p-prvky, takže valenčné elektróny sa budú nachádzať v orbitály p,
– protónové číslo je 34.
Budeme postupovať podľa výstavbového princípu
(orbitály s nižšou energiou sa zapĺňajú skôr):
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4.
1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p4.

Súčet všetkých čísel v hornom indexe (počet elektrónov v jednotlivých orbitáloch) sa musí zhodovať s protónovým číslom – počtom elektrónov.
Spočítame horné indexy: 2 + 2 + 6 + 2 + 6 +2 + 10 + 4 = 34!
Grafické zobrazenie
Ak chceme použiť grafické zobrazenie, môžeme si nakresliť štvorce, v ktorých každý elektrón znázorníme šípkou. V každom štvorčeku môžu byť maximálne 2 šípky, z toho jedna musí mať opačný smer, ako tá druhá (spin).
Na vyjadrenie elektrónovej konfigurácie atómu prvku sa dá použiť taktiež zjednodušený zápis – pomocou vzácneho plynu. Najprv si povedzme, aké konfigurácie majú tieto prvky.
2He – 1s2
10Ne – 1s2 2s2 2p6
18Ar – 1s2 2s2 2p6 3s2 3p6
36Kr – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
54Xe – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
86Rn – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Elektrónová konfigurácia Ytria
Predstavte si, že chcete popísať elektrónovú konfiguráciu ytria, ktoré má protónové číslo 39. Chcelo by sa vám to všetko takto vypisovať? Vyzeralo by to nasledovne:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1
Nie je to až také dlhé, no keď sa dá niečo skrátiť, prečo to nevyužiť? Všimnite si, že začiatok je rovnaký, ako pri vzácnych plynoch. Až po 4p6 je konfigurácia ytria zhodná s konfiguráciou kryptónu.
Preto môžeme konfiguráciu ytria napísať nasledovne: [Kr] 5s2 4d1.
Excitovaný stav
Tieto pravidlá platia, keď je atóm v základnom stave, teda má najnižšiu energiu.
Keď mu energiu dodáme, dostane sa do excitovaného stavu. Vtedy jeden alebo viac valenčných elektrónov prejde na vyššiu hladinu a elektrónová konfigurácia sa zmení.
Napríklad uhlík:
Atóm v základnom stave má elektrónovú konfiguráciu 1s2 2s2 2p2.
Keď však pridáme energiu a dostane sa do excitovaného stavu, konfigurácia sa zmení na 1s2 2s1 2p3.
Pozor na výnimky!
Energia d orbitálu, ktorý je úplne alebo z polovice zaplnený, je nižšia, ako energia najbližšieho s orbitálu.
V prípade d4 a d9 prvkov teda jeden elektrón prechádza z s orbitálu do d orbitálu.
Napríklad – elektrónová konfigurácia 24Cr je správne [Ar] 4s1 3d5, nie [Ar] 4s2 3d4.
Elektrónová konfigurácia - zhrnutie na záver
Obal každého atómu je tvorený elektrónmi.
Elektrónová konfigurácia nám ukazuje (popisuje) obsadenie orbitálov konkrétneho atómu elektrónmi.
Orbitály sú oblasti obalu atómu, kde je výskyt elektrónov najhustejší.
Orbitály sú charakterizované troma kvantovými číslami. Ich kombináciami vieme popísať ľubovoľný orbitál v elektrónovom obale.
Zdroje:
CHRENČÍKOVÁ a spol. 2002. Zmaturuj z chémie. Brno. DIDAKTIS
DVOŘÁČKOVÁ. 2013. Chemie pro každého. Olomouc. Rubico
BENEŠOVÁ, SATRAPOVÁ. 2004. Zmaturuj z chémie. DIDAKTIS
Obrázky a školské poznámky šprta.