Chalkogény - zlúčeniny
Zlúčeniny kyslíka
Voda
Voda je najrozšírenejšia zlúčenina vodíka aj celkovo látka na Zemi.
Môže byť voľná, takisto sa však vyskytuje aj vo viazanej forme v zemskej kôre, na povrchu Zeme (hydrosféra) a atmosfére (pary, oblaky). Kvapalná voda v prírode nie je čistou látkou, obsahuje množstvo prímesí.
Pri normálnych podmienkach je čírou bezfarebnou kvapalinou, nemá chuť, ani zápach.
Prítomnosť vody je základná podmienka existencie života. Je hlavnou zložkou biomasy, aj prostriedkom na transport živín.
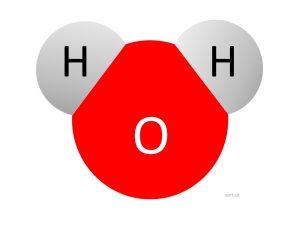
Z chemického hľadiska sa na vodu pozeráme ako na lomenú molekulu dvoch atómov vodíka a jedného atómu kyslíka, kde väzbový uhol je menší, ako ideálny. Medzi vodíkom a kyslíkom vzniká polárna väzba. Má vysoký dipólovú moment, preto slúži ako dobré rozpúšťadlo iónových látok.
Na kyslíku vzniká čiastočný záporný, na vodíku čiastočný kladný náboj, vďaka čomu sa molekuly vody spájajú vodíkovými mostíkmi. Tie spôsobujú zvýšenú teplotu topenia aj varu.
Podľa rozpustených látok vo vode ju rozdeľujeme na:
– destilovanú vodu, ktorá je zbavená všetkých minerálov
– mäkkú vodu, v ktorej sa nachádza malé množstvo minerálnych látok
– tvrdú vodu, v ktorej je obsiahnutých viac minerálnych látok.
Podľa použitia ju delíme na:
– úžitkovú vodu, ktorá je dezinfikovaná a používa sa v priemysle
– napájaciu vodu, ktorá sa používa napríklad v kotloch a neobsahuje minerálne látky
– pitnú vodu určenú na konzumáciu
Od toho, aké a koľko látok je vo vode rozpustených, závisia jej vlastnosti.
Aby sme získali pitnú vodu, musí prejsť úpravou. Prvým krokom je filtrácia, počas ktorej sa odstránia mechanické časti. Po nej nasleduje chemické čistenie, ktoré vodu zbaví aniónov a katiónov solí, až príde na rad dezinfekcia, kedy sa odstránia mikróby.
Niekedy hovoríme tiež o tvrdosti vody. Tá môže byť trvalá, alebo prechodná. Závisí najmä od podielu vápnika vo vode.
Peroxid vodíka
Peroxid vodíka je kvapalina podobná vode. Samovoľne sa však pomaly rozkladá na vodu a kyslík.
![]()
Takisto pred dosiahnutím teploty varu sa explozívne rozkladá.
Je to stredne silné oxidačné činidlo, oproti silnejším oxidovadlám sa správa ako redukovadlo.
Použitie: Trojpercentný roztok sa používa napríklad na dezinfekciu, slúži tiež ako antiseptikum ústnej dutiny, pri stomatológii.
Oxidy
Oxid je zlúčenina, ktorá pozostáva z dvoch zložiek. Obsahuje kyslík a iný prvok. Oxidy označujeme aj ako binárne zlúčeniny, lebo obsahujú len dva prvky.
Oxidy rozdeľujeme na zásadotvorné a kyselinotvorné.
Zásadotvorné (iónové) oxidy vo vodných roztokoch reagujú v dôsledku hydrolýzy oxidových iónov zásadito, vznikajú teda hydroxidy. Reakcia prebieha nasledovne:
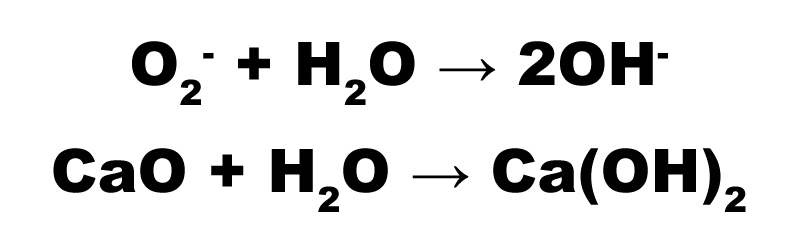
Kyselinotvorné sú oxidy nekovov a kovov, prípadne polokovov vo vyšších oxidačných číslach, rozpustné vo vode. Produktom reakcie sú kyseliny, napr.:
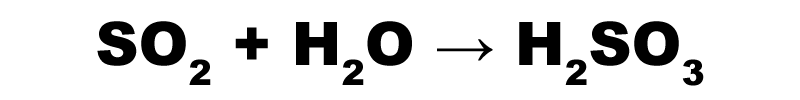
Vzájomnou reakciou kyselinotvorných a zásadotvorných oxidov vznikajú soli.
Ďalšou skupinou sú tzv. amfotérne oxidy – oxidy kovových prvkov. Tie reagujú s kyselinami a zásadami, no vo vode sú nerozpustné. Príkladmi sú BeO, alebo ZnO.
Neutrálne oxidy nie sú anhydridmi kyselín, ani zásad. Patrí sem napríklad CO.